14.下表是元素周期表的一部分,完成下列有关问题:
(1)在这些元素中,最活泼的金属元素是K(填元素符号或化学式,下同),最活泼的非金属元素是F,最不活泼的元素是Ar.
(2)在这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.
(3)在这些元素中,原子半径最小的是F,原子半径最大的是K.
(4)在③和④中,化学性质较活泼的是Na,怎样用化学实验证明?答:与H2O反应.在⑧与⑫中,化学性质较活泼的是Cl,怎样用化学实验证明?答:单质间的置换反应(氯气能置换出NaBr中的Br生成溴单质).
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)在这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.
(3)在这些元素中,原子半径最小的是F,原子半径最大的是K.
(4)在③和④中,化学性质较活泼的是Na,怎样用化学实验证明?答:与H2O反应.在⑧与⑫中,化学性质较活泼的是Cl,怎样用化学实验证明?答:单质间的置换反应(氯气能置换出NaBr中的Br生成溴单质).
13.分某学习小组在研究水处理问题时,将一定量NaClO溶液与FeSO4溶液相混合,得到含有大量悬浮物的混合液.请完成对反应物剩余情况的探究.
(1)提出合理假设:
假设1:FeSO4有剩余;
假设2:NaClO有剩余;
假设3:NaClO和FeSO4都无剩余
(2)样品初步处理:取少量混合液于试管中,滴加足量稀硫酸得到澄清溶液.此澄清溶液中肯定含有的金属阳离子是Na+,Fe3+
(3)设计后续实验方案验证假设.请在答题卡上写出实验步骤以及预期现象和结论.限选实验试剂:3mol.L-1 H2SO4,0.01mol•L-1 KMnO4,20% KSCN、3% H2O2,淀粉-KI溶液、紫色石蕊溶液.
(1)提出合理假设:
假设1:FeSO4有剩余;
假设2:NaClO有剩余;
假设3:NaClO和FeSO4都无剩余
(2)样品初步处理:取少量混合液于试管中,滴加足量稀硫酸得到澄清溶液.此澄清溶液中肯定含有的金属阳离子是Na+,Fe3+
| 实验步骤 | 预期现象和结论 | |
| 步骤1 | 将上述澄清溶液分置于A、B试管中. | |
| 步骤2 | ||
| 步骤3 | ||
12.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填具体元素符号或化学式,下同).原子结构示意图为 .
.
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的是:KOH.
(3)最高价氧化物是两性氧化物的元素是Al;写出它的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(4)用电子式表示元素④与⑥的化合物的形成过程: ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.
(5)元素的气态氢化物中成碱性的物质是NH3,该元素氢化物与其最高价氧化物对应水化物反应的化学方程式为NH3+HNO3=NH4NO3.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
 .
.(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的是:KOH.
(3)最高价氧化物是两性氧化物的元素是Al;写出它的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(4)用电子式表示元素④与⑥的化合物的形成过程:
 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.(5)元素的气态氢化物中成碱性的物质是NH3,该元素氢化物与其最高价氧化物对应水化物反应的化学方程式为NH3+HNO3=NH4NO3.
11.下面是实验探究同一主族元素性质的递变规律
(1)探究碱金属从锂到铯金属性的递变规律,通常设计Na、K单质与水反应对比来说明.请描述K与水反应的现象钾迅速熔化成一小球,四处游动,发出轻微爆炸声,有紫色火焰产生,反应的化学方程式为2K+2H2O=2KOH+H2↑,比Na跟水反应更剧烈.
(2)探究卤素从F到I的非金属性的递变规律
某学生设计了如下的实验方案,请帮助该学生整理并完成实验报告.
①实验用品
仪器:试管、胶头滴管
药品:新制的氯水、氯化钠溶液、溴化钠溶液、KI溶液、四氯化碳
②实验内容(在下表留空的格中填写相关内容)
(1)探究碱金属从锂到铯金属性的递变规律,通常设计Na、K单质与水反应对比来说明.请描述K与水反应的现象钾迅速熔化成一小球,四处游动,发出轻微爆炸声,有紫色火焰产生,反应的化学方程式为2K+2H2O=2KOH+H2↑,比Na跟水反应更剧烈.
(2)探究卤素从F到I的非金属性的递变规律
某学生设计了如下的实验方案,请帮助该学生整理并完成实验报告.
①实验用品
仪器:试管、胶头滴管
药品:新制的氯水、氯化钠溶液、溴化钠溶液、KI溶液、四氯化碳
②实验内容(在下表留空的格中填写相关内容)
| 步骤 | 实验方案 | 实验现象(描述最后的) | 离子方程式 |
| ① | 先向试管中加入溴化钠溶液2ml,再加入4-5滴新制氯水,振荡后分两份,取一份又加入CCl4,振荡、静置 | 上层为浅黄色(或无色),下层为橙色 | Cl2+2Br-=Br2+2Cl- |
| ② | 取少量KI溶液于试管,加入几滴步骤①留下的另一份溶液,振荡,又加入CCl4,振荡、静置 | 上层为浅黄色(或无色),下层为紫红色 | Br2+2I-=I2+2Br- |
| 结论 | 氧化性:Cl2>Br2>I2(非金属性:Cl>Br>I) | ||
10.如图为周期表的一部分,所有元素都是主族元素,不正确的是( )
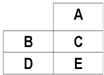

| A. | E的核电荷数大于B | |
| B. | A、C若为非金属,则对应氢化物的稳定性:A>C | |
| C. | B、D若为金属,其最高价氧化物对应水化物碱性:D>B | |
| D. | A一定是非金属元素 |
9.下列说法正确的是( )
| A. | 用福尔马林对种子消毒不属于蛋白质变性 | |
| B. | 能用新制的氢氧化铜鉴别果糖与葡萄糖溶液 | |
| C. | 实验证实化合物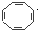 可使Br2的CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 可使Br2的CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 | |
| D. | 化合物的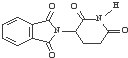 分子式为C13H8O4N2 分子式为C13H8O4N2 |
7.下表为元素周期表的一部分,请回答有关问题:
(1)⑧的元素符号是Ar;单质是原子晶体的是Si;(填写元素符号,(2)小题同)
(2)表中最活泼的金属是K,单质常温下是液体的元素是Br;
(3)表中能形成两性氢氧化物的元素是Al,分别写出该元素的最高氧化物的水化物与⑥、⑨最高价氧化物的水化物反应的离子方程式:Al(OH)3+3H+=Al3++3H2O,Al(OH)3+OH-=AlO2-+2H2O;
(4)写出一个离子方程式,比较⑦、⑩单质氧化性的强弱:Cl2+2Br-=Br2+2Cl-.
| IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
(2)表中最活泼的金属是K,单质常温下是液体的元素是Br;
(3)表中能形成两性氢氧化物的元素是Al,分别写出该元素的最高氧化物的水化物与⑥、⑨最高价氧化物的水化物反应的离子方程式:Al(OH)3+3H+=Al3++3H2O,Al(OH)3+OH-=AlO2-+2H2O;
(4)写出一个离子方程式,比较⑦、⑩单质氧化性的强弱:Cl2+2Br-=Br2+2Cl-.
6.HA为酸性略强于醋酸的一元弱酸,则下列叙述正确的是( )
| A. | 0.1mol•L-1 HA 中c(H+)=c(OH-)+c(A-), | |
| B. | 0.1mol•L-1 HA 与 0.1 mol•L-1NaOH 混合至溶液呈中性:c(Na+)<c(A-) | |
| C. | 0.1mol•L-1 NaA 中c(Na+)>c(OH-)>c(A-)>c(H+) | |
| D. | 0.1mol•L-1 HA中加入少量NaA固体,HA的电离常数减小 |
5.某实验小组的同学为了探究CuSO4溶液与Na2CO3溶液的反应原理并验证产物,进行如下实验.
实验I:将CuSO4溶液与Na2CO3溶液混合,一定温度下充分反应至不产生气泡为止,
过滤、冷水洗涤、低温干燥,得到蓝绿色固体.该小组同学猜想此固体为xCuCO3•yCu(OH)2.
(1)为了验证猜想,先进行定性实验.
(2)为进一步确定蓝绿色固体的组成,使用如下装置再进行定量实验.

实验Ⅲ:称取5.190g样品,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置C和D中.
①装置C中盛放的试剂是无水氯化钙,装置E的作用是防止空气中的二氧化碳和水蒸气进入装置D影响测定结果,反应结束时要通入适量的空气,其作用是使分解产生的水蒸气、二氧化碳气体全部进入装置C、D中吸收.
②实验结束后,测得装置C增重0.270g,装置D增重1.320g.则该蓝绿色固体的化学式为2CuCO3•Cu(OH)2.
(3)若x=y=1,写出CuSO4溶液与Na2CO3溶液混合时反应的化学方程式2CuSO4+2Na2CO3+H2O=CuCO3•Cu(OH)2↓+CO2↑+Na2SO4.
(4)已知20℃时溶解度数据:S[Ca(OH)2]=0.16g,S[Ba(OH)2]=3.89g.有同学据此提出可将装置D中的澄清石灰水换成等体积的饱和Ba(OH)2溶液,其可能的依据之一是Ba(OH)2溶解度大于Ca(OH)2,相同体积的饱和氢氧化钡溶液吸收二氧化碳多.
(5)有同学为了降低实验误差,提出如下建议,其中合理的是(填字母序号).
A.加热装置B前,先通空气一段时间后再称量C、D的初始质量
B.将D换为盛有碱石灰的U形管
C.将C、D颠倒并省去E装置.
0 167508 167516 167522 167526 167532 167534 167538 167544 167546 167552 167558 167562 167564 167568 167574 167576 167582 167586 167588 167592 167594 167598 167600 167602 167603 167604 167606 167607 167608 167610 167612 167616 167618 167622 167624 167628 167634 167636 167642 167646 167648 167652 167658 167664 167666 167672 167676 167678 167684 167688 167694 167702 203614
实验I:将CuSO4溶液与Na2CO3溶液混合,一定温度下充分反应至不产生气泡为止,
过滤、冷水洗涤、低温干燥,得到蓝绿色固体.该小组同学猜想此固体为xCuCO3•yCu(OH)2.
(1)为了验证猜想,先进行定性实验.
| 实验序号 | 实验步骤 | 实验现象 | 结论 |
| 实验Ⅱ | 取适量蓝绿色固体,加入足量稀硫酸 | 固体溶解,生成蓝色溶液, 产生无色气体 | 蓝绿色固体中含有C${{O}_{3}}^{2-}$ |

实验Ⅲ:称取5.190g样品,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置C和D中.
①装置C中盛放的试剂是无水氯化钙,装置E的作用是防止空气中的二氧化碳和水蒸气进入装置D影响测定结果,反应结束时要通入适量的空气,其作用是使分解产生的水蒸气、二氧化碳气体全部进入装置C、D中吸收.
②实验结束后,测得装置C增重0.270g,装置D增重1.320g.则该蓝绿色固体的化学式为2CuCO3•Cu(OH)2.
(3)若x=y=1,写出CuSO4溶液与Na2CO3溶液混合时反应的化学方程式2CuSO4+2Na2CO3+H2O=CuCO3•Cu(OH)2↓+CO2↑+Na2SO4.
(4)已知20℃时溶解度数据:S[Ca(OH)2]=0.16g,S[Ba(OH)2]=3.89g.有同学据此提出可将装置D中的澄清石灰水换成等体积的饱和Ba(OH)2溶液,其可能的依据之一是Ba(OH)2溶解度大于Ca(OH)2,相同体积的饱和氢氧化钡溶液吸收二氧化碳多.
(5)有同学为了降低实验误差,提出如下建议,其中合理的是(填字母序号).
A.加热装置B前,先通空气一段时间后再称量C、D的初始质量
B.将D换为盛有碱石灰的U形管
C.将C、D颠倒并省去E装置.
