题目内容
10.如图为周期表的一部分,所有元素都是主族元素,不正确的是( )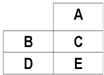
| A. | E的核电荷数大于B | |
| B. | A、C若为非金属,则对应氢化物的稳定性:A>C | |
| C. | B、D若为金属,其最高价氧化物对应水化物碱性:D>B | |
| D. | A一定是非金属元素 |
分析 由图得知,此五种元素均为主族元素,且占据周期表的三个周期,故应为IIIA族之后的元素,
A、E的电子层数比B多1,电子层数越多,核电荷数越多;
B、同一主族元素,原子序数越大,其应氢化物的稳定性越弱;
C、金属性越强,其最高价氧化物的水合物的碱性越强;
D、若B为IIIA族元素,那么A为IVA族元素,A可以是锗.
解答 解:A、E的电子层数大于B,故E的核电荷数大于B的核电荷数,故A正确;
B、A、C若为非金属,由于C在A的下一周期,同一主族元素,原子序数越大,其应氢化物的稳定性越弱,故氢化物稳定性:A>C,故B正确;
C、B、D若为金属,那么金属性D>B,那么其最高价氧化物对应水化物碱性:D>B,故C正确;
D、若B为IIIA族元素,那么A为IVA族元素,A可以是锗,为金属元素,故D错误,
故选D.
点评 本题侧重考查元素周期表结构、元素周期律,熟练掌握元素周期表的递变规律是解决本题的关键,有一定难度.

练习册系列答案
相关题目
4.下列事实能用元素周期律解释的是( )
| A. | 沸点:H2O>H2Se>H2S | B. | 酸性:H2SO4>H2CO3>HClO | ||
| C. | 硬度:I2>Br2>Cl2 | D. | 碱性:KOH>NaOH>Al(OH)3 |
5.某实验小组的同学为了探究CuSO4溶液与Na2CO3溶液的反应原理并验证产物,进行如下实验.
实验I:将CuSO4溶液与Na2CO3溶液混合,一定温度下充分反应至不产生气泡为止,
过滤、冷水洗涤、低温干燥,得到蓝绿色固体.该小组同学猜想此固体为xCuCO3•yCu(OH)2.
(1)为了验证猜想,先进行定性实验.
(2)为进一步确定蓝绿色固体的组成,使用如下装置再进行定量实验.

实验Ⅲ:称取5.190g样品,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置C和D中.
①装置C中盛放的试剂是无水氯化钙,装置E的作用是防止空气中的二氧化碳和水蒸气进入装置D影响测定结果,反应结束时要通入适量的空气,其作用是使分解产生的水蒸气、二氧化碳气体全部进入装置C、D中吸收.
②实验结束后,测得装置C增重0.270g,装置D增重1.320g.则该蓝绿色固体的化学式为2CuCO3•Cu(OH)2.
(3)若x=y=1,写出CuSO4溶液与Na2CO3溶液混合时反应的化学方程式2CuSO4+2Na2CO3+H2O=CuCO3•Cu(OH)2↓+CO2↑+Na2SO4.
(4)已知20℃时溶解度数据:S[Ca(OH)2]=0.16g,S[Ba(OH)2]=3.89g.有同学据此提出可将装置D中的澄清石灰水换成等体积的饱和Ba(OH)2溶液,其可能的依据之一是Ba(OH)2溶解度大于Ca(OH)2,相同体积的饱和氢氧化钡溶液吸收二氧化碳多.
(5)有同学为了降低实验误差,提出如下建议,其中合理的是(填字母序号).
A.加热装置B前,先通空气一段时间后再称量C、D的初始质量
B.将D换为盛有碱石灰的U形管
C.将C、D颠倒并省去E装置.
实验I:将CuSO4溶液与Na2CO3溶液混合,一定温度下充分反应至不产生气泡为止,
过滤、冷水洗涤、低温干燥,得到蓝绿色固体.该小组同学猜想此固体为xCuCO3•yCu(OH)2.
(1)为了验证猜想,先进行定性实验.
| 实验序号 | 实验步骤 | 实验现象 | 结论 |
| 实验Ⅱ | 取适量蓝绿色固体,加入足量稀硫酸 | 固体溶解,生成蓝色溶液, 产生无色气体 | 蓝绿色固体中含有C${{O}_{3}}^{2-}$ |

实验Ⅲ:称取5.190g样品,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置C和D中.
①装置C中盛放的试剂是无水氯化钙,装置E的作用是防止空气中的二氧化碳和水蒸气进入装置D影响测定结果,反应结束时要通入适量的空气,其作用是使分解产生的水蒸气、二氧化碳气体全部进入装置C、D中吸收.
②实验结束后,测得装置C增重0.270g,装置D增重1.320g.则该蓝绿色固体的化学式为2CuCO3•Cu(OH)2.
(3)若x=y=1,写出CuSO4溶液与Na2CO3溶液混合时反应的化学方程式2CuSO4+2Na2CO3+H2O=CuCO3•Cu(OH)2↓+CO2↑+Na2SO4.
(4)已知20℃时溶解度数据:S[Ca(OH)2]=0.16g,S[Ba(OH)2]=3.89g.有同学据此提出可将装置D中的澄清石灰水换成等体积的饱和Ba(OH)2溶液,其可能的依据之一是Ba(OH)2溶解度大于Ca(OH)2,相同体积的饱和氢氧化钡溶液吸收二氧化碳多.
(5)有同学为了降低实验误差,提出如下建议,其中合理的是(填字母序号).
A.加热装置B前,先通空气一段时间后再称量C、D的初始质量
B.将D换为盛有碱石灰的U形管
C.将C、D颠倒并省去E装置.
15.化学与生产、生活关系密切,下列现象或事实及其分析都正确的是( )
| 选项 | 现象或事实 | 分析 |
| A | 发电厂将燃煤产生的废气通入高温下的石灰石 | 主要目的是生产CaSO4并得到副产品CO2 |
| B | ClO2代替Cl2对饮用水消毒 | ClO2消毒杀毒效率高,二次污染小 |
| C | 苏打、苛性钠可用于治疗胃酸过多 | 苏打、苛性钠都与胃酸反应 |
| D | 用环保绿色融雪除冰剂代替氯化钙、氯化钠融雪除冰 | 氯化钙、氯化钠会造成环境污染,但不会加速桥梁等设备腐蚀 |
| A. | A | B. | B | C. | C | D. | D |
2.下列递变情况中,正确的是( )
| A. | Na、Mg、Al原子的失电子能力依次增强 | |
| B. | Li、Na、K的最高价氧化物对应的水化物的碱性依次减弱 | |
| C. | Si、P、S元素的气态氢化物的稳定性依次降低 | |
| D. | C、N、O的原子半径依次减小 |