题目内容
14.下表是元素周期表的一部分,完成下列有关问题:| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)在这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.
(3)在这些元素中,原子半径最小的是F,原子半径最大的是K.
(4)在③和④中,化学性质较活泼的是Na,怎样用化学实验证明?答:与H2O反应.在⑧与⑫中,化学性质较活泼的是Cl,怎样用化学实验证明?答:单质间的置换反应(氯气能置换出NaBr中的Br生成溴单质).
分析 依据各个元素所在周期表中的位置可知:①为N,②为F,③为Na,④为Mg,⑤为Al,⑥为Si,⑦为S,⑧为Cl,⑨为Ar,⑩为K,⑪为Ca,⑫为Br,
(1)根据元素金属性和非金属的递变规律解答;
(2)元素的非金属性越强,其最高价氧化物对应的水合物酸性越强,金属性越强,其最高价氧化物的水合物碱性最强,氢氧化铝为两性氢氧化物;
(3)同一周期原子序数越大,半径越小,电子层数越少,半径越小;
(4)根据元素金属性强弱和非金属性强弱的判断方法思考.
解答 解:由元素所在周期表中的位置可知:①为N,②为F,③为Na,④为Mg,⑤为Al,⑥为Si,⑦为S,⑧为Cl,⑨为Ar,⑩为K,⑪为Ca,⑫为Br,
(1)根据元素周期表性质的递变规律,最活泼的金属应在第IA,最活泼的非金属应在第VIIA,惰性气体最不活泼,则在IA元素Na(③)和K(⑩)中K最活泼;在VII元素F和Cl中,F最活泼;最不活泼的是⑨即Ar,故答案为:K;F;Ar.
(2)元素的最高价氧化物对应水化物中,酸性最强的必是非金属性最强的,根据同周期、同主族元素非金属性的递变规律可知,元素非金属性最强的是②即F,但F无最高正价,故酸性最强的是HClO4,元素的最高价氧化物对应水化物中,碱性最强的必是金属性最强的,根据同周期、同主族元素金属性的递变规律可知,元素金属性最强的是⑩即K,则碱性最强的必是KOH.在表中所列元素的最高价氧化物对应水化物中,只有Al(OH)3具有两性,故答案为:HClO4;KOH;Al(OH)3;
(3)同一周期原子序数越大,半径越小,电子层数越少,半径越小,故在这些元素中,F半径最小,K半径最大,故答案为:F;K;
(4)③和④分别是Na和Mg,根据同主族元素金属性的递变规律可知,金属性Na>Mg,根据判断金属性强弱的方法,可依据二者单质分别与水反应的剧烈程度来判断其金属性强弱,即:与H2O反应.
⑧和⑫分别是Cl和Br,根据同主族元素非金属性的递变规律可知,非金属性Cl>Br,根据判断非金属性强弱的方法,可依据二者气态氢化物的稳定性、单质之间的置换反应等来判断其非金属性强弱,即Cl2+2NaBr=2NaCl+Br2,
故答案为:Na;与H2O反应;Cl;单质间的置换反应(氯气能置换出NaBr中的Br生成溴单质).
点评 本题综合性较强,涵盖了元素周期表、元素性质的递变规律、元素金属性及非金属性强弱的判断方法等,难度不大.

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案| A. | 一定存在Fe2+、Na+、Cl- | B. | 一定不存在I-、SO32- | ||
| C. | 一定呈碱性 | D. | 一定存在NH4+ |
| A. | 用福尔马林对种子消毒不属于蛋白质变性 | |
| B. | 能用新制的氢氧化铜鉴别果糖与葡萄糖溶液 | |
| C. | 实验证实化合物 可使Br2的CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 可使Br2的CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 | |
| D. | 化合物的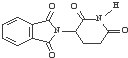 分子式为C13H8O4N2 分子式为C13H8O4N2 |
| A. | 砹是一种有色固体,它的气态氢化物很不稳定 | |
| B. | F2与水反应比Cl2与水反应剧烈 | |
| C. | 铷的最高价氧化物的水化物一定是强碱 | |
| D. | 由盐酸的酸性比氢硫酸强可推知氯的非金属性强于硫 |
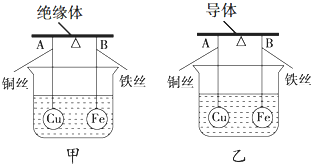
| A. | X=2Y | B. | 2X=Y | C. | X=Y | D. | 无法确定 |
| A. | 采用加热方法消毒的目的是使蛋白质变性而杀灭细菌 | |
| B. | 石油分馏可得到石油气、汽油、煤油、柴油等 | |
| C. | “海水淡化”可以解决“淡水供应危机”,加入明矾可以使海水淡化 | |
| D. | 已知Ksp(MnS)>Ksp(CdS) 所以工业上用MnO2制取MnCl2时,用MnS除去溶液中含有的Cd2+离子 |