2.下列化学反应先后顺序判断正确的是( )
| A. | 在含有等物质的量的H+、Al3+的溶液中,逐滴加入NaOH溶液:H+、Al3+、Al(OH)3 | |
| B. | 在含有等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气:I-、Br-、Fe2+ | |
| C. | 在含有等物质的量的NaCl、Na2S的溶液中加入AgN03溶液:NaCl、Na2S | |
| D. | 在含有等物质的量的Fe3+、Cu2+的溶液中加入铁粉:Cu2+、Fe3+ |
1.用下列实验装置进行相应实验,能达到实验目的是( )


| A. | 用图1所示装置可收集NO气体 | |
| B. | 用图4装置可证明酸性:H2SO4>H2CO3>H2SiO3 | |
| C. | 用图3所示装置可实现反应:2H2O$\frac{\underline{\;电解\;}}{\;}$O2↑+H2↑ | |
| D. | 用图2所示装置可吸收多余氨气且能防止倒吸 |
20.两种醇的混合物4.176g与足量金属钠反应得到氢气1.344L(标况状况),该混合物中,两种醇的物质量之比为( )
| A. | 乙二醇和丙三醇是1:1 | B. | 乙醇和乙二醇是1:2 | ||
| C. | 甲醇和乙醇是5:1 | D. | 甲醇和乙醇是4:1 |
19.设NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1.00 mol•L-1 NaCl溶液中含有Na+的数目为NA | |
| B. | 常温常压下,6.4 g由氧气和臭氧组成的混合物中含有的分子总数为0.2NA | |
| C. | 标准状况下,1.12 L HCHO中C原子的数目为0.05 NA | |
| D. | 在催化剂作用下,6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2NA |
18.下列微粒可以大量共存于同一溶液中的是( )
| A. | NH4+、CH3COO-、Ca2+、Cl- | B. | Fe3+、Ag+、SO42-、NO3- | ||
| C. | Cu2+、H+、S2-、NO3- | D. | C6H5OH、Fe3+、K+、Cl- |
17.化学与生活、社会密切相关.下列有关说法正确的是( )
| A. | 在人体内酶的作用下,纤维素可以发生水解生成葡萄糖 | |
| B. | 福尔马林(甲醛溶液)可用于浸泡生肉及海产品以防腐保鲜 | |
| C. | 新型材料聚酯纤维、光导纤维都属于有机高分子材料 | |
| D. | 医药中常用酒精来消毒,是因为酒精能够使病毒的蛋白质发生变性 |
16.某小组以醋酸为例探究弱酸的性质.
(1)实验一:探究酸的强弱对酸与镁条反应速率的影响.
①设计实验方案如表,表中c=1.0 mol•L-1.
②实验步骤:a)检查装置(图1)的气密性后,添加药品;
b)反应开始后,每隔1min记录一次生成H2的体积;
c)将所记录的数据转化为曲线图(图2).
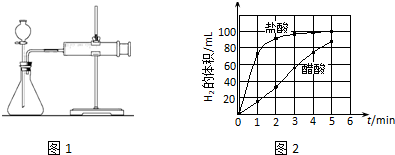
③写出0~5min醋酸、盐酸与镁条反应的反应速率变化规律:醋酸与镁条反应的速率随时间变化不明显,盐酸与镁条反应开始阶段反应速率很快,一段时间后反应速率明显减小.
(2)实验二:现有一瓶醋酸溶液,常温下测定其中醋酸的电离程度(已电离的电解质分子数占原来总分子数的百分比).
设计实验方案,将待测物理量和对应的测定方法填写在表中.
(1)实验一:探究酸的强弱对酸与镁条反应速率的影响.
①设计实验方案如表,表中c=1.0 mol•L-1.
| 编号 | 酸的种类 | 酸的浓度/mol•L-1 | 酸的体积/mL | 镁条质量/g |
| 1 | 醋酸 | 1.0 | 10 | 2.0 |
| 2 | 盐酸 | c | 10 | 2.0 |
b)反应开始后,每隔1min记录一次生成H2的体积;
c)将所记录的数据转化为曲线图(图2).

③写出0~5min醋酸、盐酸与镁条反应的反应速率变化规律:醋酸与镁条反应的速率随时间变化不明显,盐酸与镁条反应开始阶段反应速率很快,一段时间后反应速率明显减小.
(2)实验二:现有一瓶醋酸溶液,常温下测定其中醋酸的电离程度(已电离的电解质分子数占原来总分子数的百分比).
设计实验方案,将待测物理量和对应的测定方法填写在表中.
| 待测物理量 | 测定方法 |
| ①醋酸溶液的物质的量浓度 | 量取25.00ml醋酸溶液于锥形瓶中,滴加指示剂,将0.1000 mol•L-1 NaOH标准溶液装入 碱式滴定管,滴定至终点,记录数据.重复滴定2次. |
| ②H+的物质的量浓度 | 取适量醋酸溶液于烧杯中,用pH计测定溶液pH |
15.下列实验操作、现象和结论均正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 向FeSO4溶液中滴入少量酸性KMnO4溶液 | KMnO4溶液紫色褪去 | Fe2+有氧化性 |
| B | 向Na2SiO3溶液中通入适量的CO2 | 产生白色胶状物质 | 酸性:H2CO3>H2SiO3 |
| C | 将新制氯水和NaBr溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液呈橙红色 | 氧化性:Cl2>Br2 |
| D | 向Al2(SO4)3溶液中滴加过量氨水 | 溶液先浑浊后澄清 | Al3+与NH3•H2O不能大量共存 |
| A. | A | B. | B | C. | C | D. | D |
14.某小组为研究原电池原理,设计如图装置,下列叙述正确的是( )


| A. | 若X为Fe,Y为Cu,铁为正极 | |
| B. | 若X为Fe,Y为Cu,电子由铜片流向铁片 | |
| C. | 若X为Fe,Y为C,碳棒上有红色固体析出 | |
| D. | 若X为Cu,Y为Zn,锌片发生还原反应 |
13.设nA为阿伏加德罗常数的数值,下列说法正确的是( )
0 167456 167464 167470 167474 167480 167482 167486 167492 167494 167500 167506 167510 167512 167516 167522 167524 167530 167534 167536 167540 167542 167546 167548 167550 167551 167552 167554 167555 167556 167558 167560 167564 167566 167570 167572 167576 167582 167584 167590 167594 167596 167600 167606 167612 167614 167620 167624 167626 167632 167636 167642 167650 203614
| A. | 0.1 mol•L-1Ba(OH)2溶液中含有0.2nA个OH- | |
| B. | 1mol Na与足量水反应,转移2nA个电子 | |
| C. | 常温常压下,22.4L乙烯含有nA个CH2=CH2分子 | |
| D. | 常温常压下,46g NO2含有2nA个氧原子 |