题目内容
19.设NA代表阿伏加德罗常数的值,下列叙述正确的是( )| A. | 1.00 mol•L-1 NaCl溶液中含有Na+的数目为NA | |
| B. | 常温常压下,6.4 g由氧气和臭氧组成的混合物中含有的分子总数为0.2NA | |
| C. | 标准状况下,1.12 L HCHO中C原子的数目为0.05 NA | |
| D. | 在催化剂作用下,6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2NA |
分析 A、溶液体积不明确;
B、氧气和臭氧的摩尔质量分别是32g/mol和48g/mol;
C、标况下,甲醛为气体;
D、SO2与氧气反应生成SO3的反应为可逆反应.
解答 解:A、溶液体积不明确,故溶液中钠离子的个数无法计算,故A错误;
B、氧气和臭氧的摩尔质量分别是32g/mol和48g/mol,故6.4 g由氧气和臭氧组成的混合物的物质的量介于$\frac{6.4g}{32g/mol}$到$\frac{6.4g}{48g/mol}$即0.2mol到0.15mol之间,故分子数介于0.2NA到0.15NA之间,故B错误;
C、标况下,甲醛为气体,故1.12L甲醛的物质的量为0.05mol,故含有0.05mol碳原子,故C正确;
D、SO2与氧气反应生成SO3的反应为可逆反应,不能进行彻底,故转移电子数小于0.2NA,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
9.铊(Tl)与铝同族.Tl3+在酸性溶液中能发生反应:Tl3++2Ag→Tl++2Ag+.下列推断错误的是( )
| A. | Tl+的最外层有1个电子 | B. | Tl能形成+3价和+1价的化合物 | ||
| C. | 酸性溶液中Tl3+比Tl+氧化性强 | D. | Tl+的还原性比Ag弱 |
10.下列说法中,不正确的是( )
| A. | H、D、T互为同位素 | |
| B. | NaHCO3、HCOONa均含有离子键和共价键 | |
| C. | 常温常压下,22.4 L CCl4含有NA个CCl4分子 | |
| D. | 常温下,23 g NO2含有NA个氧原子 |
14.某小组为研究原电池原理,设计如图装置,下列叙述正确的是( )


| A. | 若X为Fe,Y为Cu,铁为正极 | |
| B. | 若X为Fe,Y为Cu,电子由铜片流向铁片 | |
| C. | 若X为Fe,Y为C,碳棒上有红色固体析出 | |
| D. | 若X为Cu,Y为Zn,锌片发生还原反应 |
4.如图图示与对应的叙述不相符的是( )


| A. | 图1的目的是检验装置的气密性 | |
| B. | 图2中分液漏斗振荡静置后,上层液体颜色变浅 | |
| C. | 图3中电流计的指针不发生偏转 | |
| D. | 图4液态水分解的热化学方程式为:2H2O(1)═2H2(g)+O2(g)△H=+571.6KJ/mol |
11. 某一兴趣小组准备在实验室中制H2,装置如图所示.可是在实验室中发现酸液不足.为达到实验目的,则可以从长颈漏斗中加入下列试剂中的( )
某一兴趣小组准备在实验室中制H2,装置如图所示.可是在实验室中发现酸液不足.为达到实验目的,则可以从长颈漏斗中加入下列试剂中的( )
 某一兴趣小组准备在实验室中制H2,装置如图所示.可是在实验室中发现酸液不足.为达到实验目的,则可以从长颈漏斗中加入下列试剂中的( )
某一兴趣小组准备在实验室中制H2,装置如图所示.可是在实验室中发现酸液不足.为达到实验目的,则可以从长颈漏斗中加入下列试剂中的( )| A. | NaNO3溶液 | B. | 四氯化碳 | C. | 苯 | D. | Na2CO3溶液 |
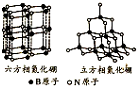 (1)短周期的元素a、b、c、d,原子序数依次增大.a原子的核外电子总数与其电子层数相同,b的基态原子各能级上排布的电子数相同,c的基态原子最高能层有3个未成对电子,d原子的最外层电子数为其内层电子数的3倍.
(1)短周期的元素a、b、c、d,原子序数依次增大.a原子的核外电子总数与其电子层数相同,b的基态原子各能级上排布的电子数相同,c的基态原子最高能层有3个未成对电子,d原子的最外层电子数为其内层电子数的3倍. (填电子式).
(填电子式).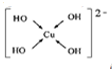 ;
;