题目内容
14.某小组为研究原电池原理,设计如图装置,下列叙述正确的是( )
| A. | 若X为Fe,Y为Cu,铁为正极 | |
| B. | 若X为Fe,Y为Cu,电子由铜片流向铁片 | |
| C. | 若X为Fe,Y为C,碳棒上有红色固体析出 | |
| D. | 若X为Cu,Y为Zn,锌片发生还原反应 |
分析 A、活泼金属作负极;
B、在原电池中电子从活泼的金属流向不活泼的金属;
C、若X为Fe,Y为C,电解质溶液为硫酸铜,则正极C上析出Cu;
D、Zn比Cu活泼,Zn作负极发生氧化反应.
解答 解:A、Fe比Cu活泼,Fe作负极,故A错误;
B、Fe比Cu活泼,Fe作负极,电子从Fe流向Cu,故B错误;
C、若X为Fe,Y为C,电解质溶液为硫酸铜,则正极C上析出Cu,故C正确;
D、Zn比Cu活泼,Zn作负极发生氧化反应,故D错误;
故选C.
点评 本题考查了原电池原理,注意活泼金属作负极发生氧化反应,电子由负极经外电路流向正极,题目难度不大.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案
相关题目
4.将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是( )
| A. | 稀硝酸 | B. | 硝酸铜 | C. | 稀盐酸 | D. | 氢氧化钠 |
5.2014年全国多个城市出现了严重的雾霾天气,十面“霾”伏,自强不“吸”等网络语流行,( )
| A. | 目前加碘食盐中主要添加的是KI | |
| B. | 光化学烟雾与大量排放碳氢化合物和氮氧化合物有关 | |
| C. | 淀粉、纤维素和聚乙烯都属于天然高分子化合物 | |
| D. | 光纤通信使用的光缆的主要成分和太阳能电池使用的材料都是SiO2 |
2.下列措施对增大化学反应速率明显增大的是( )
| A. | 使用催化剂 | B. | 增加压强 | C. | 增大反应物浓度 | D. | 升高温度 |
9.高铁电池是一种新型可充电电池,电解液为KOH溶液,放电时的总反应式为:3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH下列叙述正确的是( )
| A. | 放电时,正极区溶液的pH减小 | |
| B. | 该电用电可用稀H2SO4代替KOH溶液 | |
| C. | 充电时,电解质溶液中的K+等阳离子向Zn电极移动 | |
| D. | 充电时,每转移3 mol电子,阳极有1 mol Fe(OH)3被还原 |
19.设NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1.00 mol•L-1 NaCl溶液中含有Na+的数目为NA | |
| B. | 常温常压下,6.4 g由氧气和臭氧组成的混合物中含有的分子总数为0.2NA | |
| C. | 标准状况下,1.12 L HCHO中C原子的数目为0.05 NA | |
| D. | 在催化剂作用下,6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2NA |
7.向一种溶液中滴加另一种溶液后,溶液的颜色不发生显著变化的是( )
| A. | 硝酸亚铁溶液中加入稀硫酸 | |
| B. | 含有酚酞的碳酸钠溶液中加入足量的氧化钙溶液 | |
| C. | 硫酸铜溶液中滴加硝酸钡溶液 | |
| D. | 高锰酸钾酸性溶液中滴加亚硫酸钠溶液 |
8.化学椭圆生活息息相关,下列有关说法正确的是( )
| A. | 明矾可用于自来水的杀菌消毒 | |
| B. | 钢铁在干燥的空气里不易被腐蚀,而在潮湿的空气里容易被腐蚀 | |
| C. | 生石灰能与水反应,可用来干燥氧气 | |
| D. | SiO2可用于制半导体材料,是利用了SiO2的导电性 |
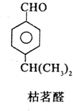 $→_{一定条件}^{试剂X}$A
$→_{一定条件}^{试剂X}$A B$→_{一定条件}^{2H_{2},Ni}$C$→_{△}^{Cu,O_{2}}$
B$→_{一定条件}^{2H_{2},Ni}$C$→_{△}^{Cu,O_{2}}$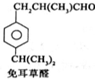
 $→_{-H_{2}O}^{△}$
$→_{-H_{2}O}^{△}$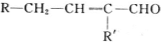
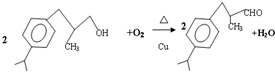 +H20.
+H20. 、
、 .
.