题目内容
1.用下列实验装置进行相应实验,能达到实验目的是( )
| A. | 用图1所示装置可收集NO气体 | |
| B. | 用图4装置可证明酸性:H2SO4>H2CO3>H2SiO3 | |
| C. | 用图3所示装置可实现反应:2H2O$\frac{\underline{\;电解\;}}{\;}$O2↑+H2↑ | |
| D. | 用图2所示装置可吸收多余氨气且能防止倒吸 |
分析 A.NO只能用排水法收集,气体进出方向错误;
B.根据强酸制备弱酸的原理判断;
C.电解水,如氧气生成氧气,则阳极不能用非惰性电极;
D.为防止倒吸,氨气不能直接通入稀硫酸.
解答 解:A.NO只能用排水法收集,气体应从短管进,长管出,故A错误;
B.硫酸与碳酸钠反应生成二氧化碳,二氧化碳气体通入硅酸钠溶液中可得硅酸沉淀,可证明酸性强弱,故B正确;
C.电解水,如氧气生成氧气,则阳极不能用非惰性电极,故C错误;
D.为防止倒吸,氨气不能直接通入稀硫酸,可用四氯化碳,故D错误.
故选B.
点评 本题考查化学实验方案的评价,涉及气体的收集、物质的检验、电解等,注意化学实验操作的考查,熟悉高考中对化学实验注意事项及操作要点的考查,题目难度中等.

练习册系列答案
相关题目
11.铜与浓硫酸反应结束后,烧瓶中铜片未完全溶解.若向反应后的溶液中加入下列物质,相关推断错误的是( )
| A. | 加入铁粉,铁粉不溶解 | B. | 滴入NaNO3溶液,铜片不溶解 | ||
| C. | 加入银粉,银粉不溶解 | D. | 滴入NaHCO3溶液,有气体产生 |
12.下列关于化学与生产、生活的认识正确的是( )
| A. | 用米汤检验含碘盐中的碘酸钾 | |
| B. | 纤维素、蛋白质、塑料、天然橡胶都是高分子化合物 | |
| C. | 日常生活中常用无水乙醇进行杀菌消毒 | |
| D. | 光化学烟雾、臭氧层空洞、温室效应、硝酸型酸雨的形成都与氮氧化合物有关 |
9.高铁电池是一种新型可充电电池,电解液为KOH溶液,放电时的总反应式为:3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH下列叙述正确的是( )
| A. | 放电时,正极区溶液的pH减小 | |
| B. | 该电用电可用稀H2SO4代替KOH溶液 | |
| C. | 充电时,电解质溶液中的K+等阳离子向Zn电极移动 | |
| D. | 充电时,每转移3 mol电子,阳极有1 mol Fe(OH)3被还原 |
16.某小组以醋酸为例探究弱酸的性质.
(1)实验一:探究酸的强弱对酸与镁条反应速率的影响.
①设计实验方案如表,表中c=1.0 mol•L-1.
②实验步骤:a)检查装置(图1)的气密性后,添加药品;
b)反应开始后,每隔1min记录一次生成H2的体积;
c)将所记录的数据转化为曲线图(图2).
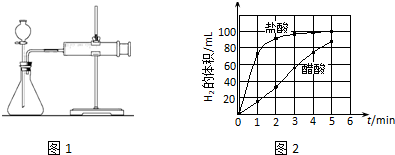
③写出0~5min醋酸、盐酸与镁条反应的反应速率变化规律:醋酸与镁条反应的速率随时间变化不明显,盐酸与镁条反应开始阶段反应速率很快,一段时间后反应速率明显减小.
(2)实验二:现有一瓶醋酸溶液,常温下测定其中醋酸的电离程度(已电离的电解质分子数占原来总分子数的百分比).
设计实验方案,将待测物理量和对应的测定方法填写在表中.
(1)实验一:探究酸的强弱对酸与镁条反应速率的影响.
①设计实验方案如表,表中c=1.0 mol•L-1.
| 编号 | 酸的种类 | 酸的浓度/mol•L-1 | 酸的体积/mL | 镁条质量/g |
| 1 | 醋酸 | 1.0 | 10 | 2.0 |
| 2 | 盐酸 | c | 10 | 2.0 |
b)反应开始后,每隔1min记录一次生成H2的体积;
c)将所记录的数据转化为曲线图(图2).

③写出0~5min醋酸、盐酸与镁条反应的反应速率变化规律:醋酸与镁条反应的速率随时间变化不明显,盐酸与镁条反应开始阶段反应速率很快,一段时间后反应速率明显减小.
(2)实验二:现有一瓶醋酸溶液,常温下测定其中醋酸的电离程度(已电离的电解质分子数占原来总分子数的百分比).
设计实验方案,将待测物理量和对应的测定方法填写在表中.
| 待测物理量 | 测定方法 |
| ①醋酸溶液的物质的量浓度 | 量取25.00ml醋酸溶液于锥形瓶中,滴加指示剂,将0.1000 mol•L-1 NaOH标准溶液装入 碱式滴定管,滴定至终点,记录数据.重复滴定2次. |
| ②H+的物质的量浓度 | 取适量醋酸溶液于烧杯中,用pH计测定溶液pH |
13.从海带中提取碘,可经过如图实验步骤完成.下列有关说法正确的是( )

| A. | 灼烧过程中使用的玻璃仪器有酒精灯、坩埚、玻璃棒 | |
| B. | 氧化过程中发生反应的离子方程式为:2I-+H2O2→I2+2OH- | |
| C. | 检验碘单质时,可选用淀粉碘化钾试纸,若试纸变蓝说明有碘单质 | |
| D. | 分液时,先打开活塞放出下层液体,再关闭活塞倒出上层液体 |
14.短周期元素X、Y、Z、W、Q原子序数逐渐增大,X的氢化物极易溶于Y的氢化物,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液.由此得出的正确结论是( )
| A. | 元素Y的最高正价是+6 | |
| B. | 离子半径的大小顺序为W>Q>Z>X>Y | |
| C. | 元素X的最高价氧化物对应水化物的酸性比Q的强 | |
| D. | 氢化物的沸点Y>W |
15.短周期主族X、Y、Z、W、Q的原子序数依次增大,X+中只含有1个质子,Y原子的最外层电子数是内层电子数的2倍,Z 和 Q同主族且能形成两种常见化合物QZ2、QZ3,W是短周期中原子半径最大的元素.下列叙述正确的是( )
| A. | Y3X8分子中,极性键和非极性键的个数比为8:3 | |
| B. | Z和Q形成的两种化合物中只有一种属于酸性氧化物 | |
| C. | 25℃时,若WZX溶液中的C(OH-):C(H+)=1012,则该溶液的pH=13 | |
| D. | Q元素在自然界中不能以游离态存在 |
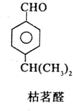 $→_{一定条件}^{试剂X}$A
$→_{一定条件}^{试剂X}$A B$→_{一定条件}^{2H_{2},Ni}$C$→_{△}^{Cu,O_{2}}$
B$→_{一定条件}^{2H_{2},Ni}$C$→_{△}^{Cu,O_{2}}$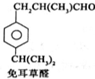
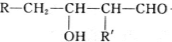 $→_{-H_{2}O}^{△}$
$→_{-H_{2}O}^{△}$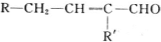
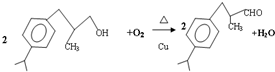 +H20.
+H20.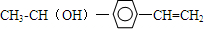 、
、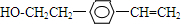 .
.