2. 如图所示的装置,试管中盛有水,气球a中盛有干燥的Na2O2粉末,U形管中注有浅红色的水.将气球用橡皮绳紧系在试管口.实验时将气球中的Na2O2抖落到试管b的水中,将发生的现象是( )
如图所示的装置,试管中盛有水,气球a中盛有干燥的Na2O2粉末,U形管中注有浅红色的水.将气球用橡皮绳紧系在试管口.实验时将气球中的Na2O2抖落到试管b的水中,将发生的现象是( )
 如图所示的装置,试管中盛有水,气球a中盛有干燥的Na2O2粉末,U形管中注有浅红色的水.将气球用橡皮绳紧系在试管口.实验时将气球中的Na2O2抖落到试管b的水中,将发生的现象是( )
如图所示的装置,试管中盛有水,气球a中盛有干燥的Na2O2粉末,U形管中注有浅红色的水.将气球用橡皮绳紧系在试管口.实验时将气球中的Na2O2抖落到试管b的水中,将发生的现象是( )| A. | U形管内水的红水褪色 | B. | 试管内溶液变红 | ||
| C. | 气球a被吹大 | D. | U形管中水位不变 |
1.设NA代表阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 25℃时,pH=11的Na2CO3溶液中水电离出来的H+数目为10-3NA | |
| B. | 78gNa2S和Na2O2的混合物中阴离子的数目为2NA | |
| C. | 在标准状况下,11.2LCCI4分子中氯原子数目为2NA | |
| D. | 室温下,4.4g乙醛和乙酸乙酯的混合物中含有碳原子数目为0.2NA |
19.下表是25℃时几种酸的电离平衡常数,结合相关数据和所学知识分析下列说法,其中正确的是( )
| 酸 | CH3COOH | HCN | HF | H2CO3 |
| 电离常数 | 1.8×10-5 | 4.9×10-10 | 6.6×10-4 | Ka1=4.3×10-2Ka2=5.6×10-11 |
| A. | 5种钠盐溶液pH大小关系pH(Na2CO3)>pH(NaCN)>pH(NaHCO3)>pH(CH3COONa)>pH(NaF) | |
| B. | 2mol•L-1HCN与1mol•L-1NaOH溶液等体积混合后的溶液中:c(CN-)<c(Na+)<c(HCN) | |
| C. | 向Na2CO3溶液中滴加过量的HCN溶液;2HCN+Na2CO3=2NaCN+CO2↑+H2O | |
| D. | 含等物质的量的Na2CO3、NaHCO3的混合液中:2c(Na+)=3c(CO32-)+3C(HCO3-) |
18.下列化学现象的描述正确、解释合理的是( )
| 选项 | 实验 | 现象 | 结论或解释 |
| A | 向溶液中滴加少量氯水,再滴加KSCN溶液 | 溶液变红 | 证明溶液中含有Fe2+ |
| B | 用铜与稀硫酸检验溶液中的 NO3- | 加热后,试管口有红棕色气体产生 | 硝酸根离子在酸性条件下与铜反应生成NO2 |
| C | 将铝箔放在火焰上灼烧 | 熔化物悬挂不下落 | 铝表面生成高熔点氧化铝未熔化 |
| D | 用盐酸标准液滴定未知浓度的Na2CO3溶液 | 分别用甲基橙和酚酞做指示剂时消耗盐酸的体积相等 | 标准液的用量只与待测液的物质的量有关,与指示剂无关 |
| A. | A | B. | B | C. | C | D. | D |
17.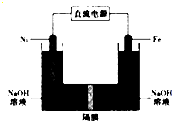 高铁酸盐在能源、环保领域有广泛用途.我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐(Na2FeO4)的方案,装置如图所示.下列说法正确的是( )
高铁酸盐在能源、环保领域有广泛用途.我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐(Na2FeO4)的方案,装置如图所示.下列说法正确的是( )
 高铁酸盐在能源、环保领域有广泛用途.我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐(Na2FeO4)的方案,装置如图所示.下列说法正确的是( )
高铁酸盐在能源、环保领域有广泛用途.我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐(Na2FeO4)的方案,装置如图所示.下列说法正确的是( )| A. | 电子的流动方向是从铁电极流出通过溶液到镍电极 | |
| B. | 铁作阳极,电极反应式为Fe+80H--6e-═FeO42-+4H20 | |
| C. | 镍作阳极,电极反应式为40H--4e-═O2+2H20 | |
| D. | 镍作阴极发生氧化反应在镍电极附近有H2生成 |
16.下列叙述正确的是( )
| A. | 室温下a L稀氨水与b L稀硫酸反应后,溶液pH=7时,c(SO42- )>c(NH4+) | |
| B. | 室温下pH=11的氨水与pH=3的盐酸等体积混合,滴人酚酞溶液呈红色 | |
| C. | 室温下两种醋酸溶液的物质的量浓度分别为c1和c2,pH依次分别为a和a+1,则Cl=l0C2 | |
| D. | 将10 mL 0.1 mol/L Na2CO3溶液逐滴滴加到10mL 0.1 mol/L盐酸中,所得溶液 c(Na+)>c(Cl-)>c(HCO3- )>c(CO32-) |
15.化学在人类生活中扮演着重要角色,以下应用正确的是( )
| A. | 硅是一种灰黑色的金属单质,是现代信息产业的重要元素 | |
| B. | 海水淡化能解决淡水供应危机,淡化海水的方法有蒸馏法、离子交换法、电渗析法等 | |
| C. | 为改善食物的色、香、味并防止变质,可在其中加入大量食品添加剂 | |
| D. | 使用无磷洗衣粉,可彻底解决水体富营养化问题 |
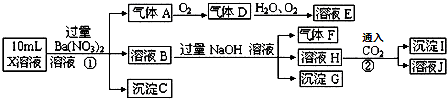
13.某pH=1的X溶液中可能含有Fe2+、Al3+,NH4+、CO32-、SO42-、Cl-中的若干种,现取X溶液进行连续实验,实验过程及产物如下:下列说法正确的是( )
0 167446 167454 167460 167464 167470 167472 167476 167482 167484 167490 167496 167500 167502 167506 167512 167514 167520 167524 167526 167530 167532 167536 167538 167540 167541 167542 167544 167545 167546 167548 167550 167554 167556 167560 167562 167566 167572 167574 167580 167584 167586 167590 167596 167602 167604 167610 167614 167616 167622 167626 167632 167640 203614

| A. | 气体A是NO2 | |
| B. | X中肯定存在Fe2+、A13+、NH4+、SO42- | |
| C. | 溶液E和气体F不能发生化学反应 | |
| D. | X中不能确定的离子是 A13+和C1- |
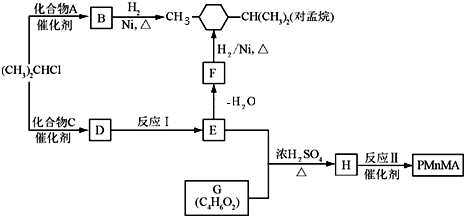

 .
.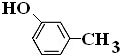 .
. .
.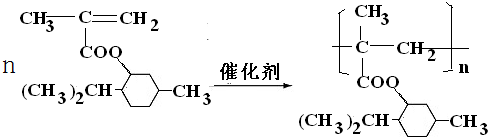 .
.