题目内容
17.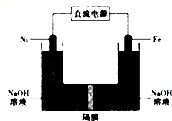 高铁酸盐在能源、环保领域有广泛用途.我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐(Na2FeO4)的方案,装置如图所示.下列说法正确的是( )
高铁酸盐在能源、环保领域有广泛用途.我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐(Na2FeO4)的方案,装置如图所示.下列说法正确的是( )| A. | 电子的流动方向是从铁电极流出通过溶液到镍电极 | |
| B. | 铁作阳极,电极反应式为Fe+80H--6e-═FeO42-+4H20 | |
| C. | 镍作阳极,电极反应式为40H--4e-═O2+2H20 | |
| D. | 镍作阴极发生氧化反应在镍电极附近有H2生成 |
分析 铁与电源的正极相连,所以铁是阳极,电极反应式为:Fe-6e-+8OH-═FeO42-+4H2O,Ni电极上氢离子放电,电极反应式为:2H2O+2e-═H2↑+2OH-,据此分析解答.
解答 解:A、电解过程中电子流向负极流向Ni电极,不能通过电解质溶液,是通过电解质溶液中离子定向移动实现闭合电路,通过Fe电极回到正极,故A错误;
B、依据装置图分析可知铁与电源正极相连做电解池阳极,碱性溶液不能生成氢离子,电极反应为Fe-6e-+8OH-═FeO42-+4H2O,故B正确;
C、镍电极上氢离子放电生成氢气,电极反应式为:2H++2e-=H2或2H2O+2e-═H2↑+2OH-,故C错误;
D、镍作阴极发生还原反应在镍电极附近有H2生成,故D错误;
故选B.
点评 本题考查了电解原理,正确判断阴阳极及发生的反应是解本题关键,易错选项是B,注意电子不能通过电解质溶液,题目难度中等.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
6.质谱图表明某有机物的相对分子质量为70,红外光谱表征到C=C和C=O的存在,1H核磁共振谱如图(峰面积之比依次为1:1:1:3),下列说法正确的是( )
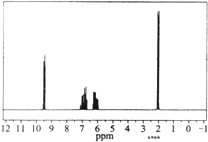

| A. | 分子中共有5种化学环境不同的氢原子 | |
| B. | 该有机物的结构简式为CH3CH=CHCOOH | |
| C. | 该物质的分子式为C4H6O | |
| D. | 该有机物不可能与氢气反应 |
8.3-苯基丙酸属于芳香酯的同分异构体共有多少种?( )
| A. | 22 | B. | 23 | C. | 24 | D. | 25 |
5.在含有Ag+的酸性溶液中,以铁氨矾NH4Fe(SO4)2作指示剂,用KSCN的标准溶液滴定Ag+.已知:AgSCN(白色s)?Ag++SCN-,Ksp=1.0×10-12;Fe3++SCN-?{Fe(SCN)}2+ (红色),K=138.下列说法中不正确的是( )
| A. | 边滴定,边摇动溶液,溶液中首先析出AgSCN白色沉淀 | |
| B. | 当溶液出现红色且半分钟不褪色时即为确定终点 | |
| C. | 上述实验可用KCl标准溶液代替KSCN的标准溶液滴定Ag+ | |
| D. | 滴定时,必须控制溶液的pH,防止Fe3+水解,影响终点的观察. |
12.下列叙述正确的是( )
| A. | 在稀硫酸中加人铜粉,铜粉不溶解;再加人NaNO3固体,铜粉仍不溶解 | |
| B. | 向明矾溶液中加人过量NaOH溶液会产生大量白色沉淀 | |
| C. | 除去FeCl3中少量的FeCl2,加人过量稀硝睃 | |
| D. | 浓硫酸、浓硝酸在加热条件下能将木炭氧化为二氧化碳 |
2.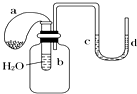 如图所示的装置,试管中盛有水,气球a中盛有干燥的Na2O2粉末,U形管中注有浅红色的水.将气球用橡皮绳紧系在试管口.实验时将气球中的Na2O2抖落到试管b的水中,将发生的现象是( )
如图所示的装置,试管中盛有水,气球a中盛有干燥的Na2O2粉末,U形管中注有浅红色的水.将气球用橡皮绳紧系在试管口.实验时将气球中的Na2O2抖落到试管b的水中,将发生的现象是( )
 如图所示的装置,试管中盛有水,气球a中盛有干燥的Na2O2粉末,U形管中注有浅红色的水.将气球用橡皮绳紧系在试管口.实验时将气球中的Na2O2抖落到试管b的水中,将发生的现象是( )
如图所示的装置,试管中盛有水,气球a中盛有干燥的Na2O2粉末,U形管中注有浅红色的水.将气球用橡皮绳紧系在试管口.实验时将气球中的Na2O2抖落到试管b的水中,将发生的现象是( )| A. | U形管内水的红水褪色 | B. | 试管内溶液变红 | ||
| C. | 气球a被吹大 | D. | U形管中水位不变 |
9.铜、锌、稀硫酸组成的原电池,当导线中通过2mole-时,下列说法正确的是( )
| A. | 锌片溶解65g,铜片上有1molH2生成 | |
| B. | 两极上溶解和析出的物质质量相等 | |
| C. | 锌片每溶解1g,铜片上就析出氢气1g | |
| D. | 锌片溶解1mol,硫酸就消耗1mol |
6.以石墨为电极分别电解水和饱和食盐水,关于两个电解池反应的说法正确的是( )
| A. | 阳极反应式相同 | |
| B. | 电解结束后所得液体的pH相同 | |
| C. | 阴极反应式相同 | |
| D. | 通过相同电量时生成的气体总体积相等(同温同压) |
7.关于下列各实验装置的叙述中,正确的是( )
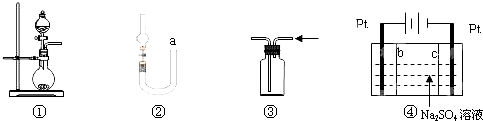

| A. | 图①可用于制取少量NH3或用MnO2和浓盐酸制取Cl2 | |
| B. | 可用从a处加水的方法检验图②装置的气密性 | |
| C. | 实验室可用图③的方法收集Cl2或NH3 | |
| D. | 利用图④装置制硫酸和氢氧化钠,其中c为阴离子交换膜、b为阳离子交换膜 |