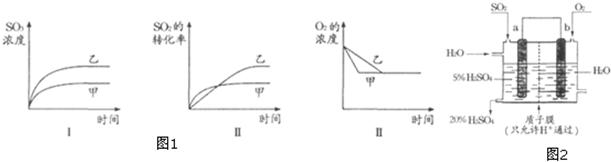
题目内容
19.下表是25℃时几种酸的电离平衡常数,结合相关数据和所学知识分析下列说法,其中正确的是( )| 酸 | CH3COOH | HCN | HF | H2CO3 |
| 电离常数 | 1.8×10-5 | 4.9×10-10 | 6.6×10-4 | Ka1=4.3×10-2Ka2=5.6×10-11 |
| A. | 5种钠盐溶液pH大小关系pH(Na2CO3)>pH(NaCN)>pH(NaHCO3)>pH(CH3COONa)>pH(NaF) | |
| B. | 2mol•L-1HCN与1mol•L-1NaOH溶液等体积混合后的溶液中:c(CN-)<c(Na+)<c(HCN) | |
| C. | 向Na2CO3溶液中滴加过量的HCN溶液;2HCN+Na2CO3=2NaCN+CO2↑+H2O | |
| D. | 含等物质的量的Na2CO3、NaHCO3的混合液中:2c(Na+)=3c(CO32-)+3C(HCO3-) |
分析 A.溶液浓度大小影响溶液的pH,缺少溶液浓度,无法判断5种钠盐溶液pH大小;
B.2mol•L-1HCN与1mol•L-1NaOH溶液等体积混合后,反应所得溶液为等浓度的HCN和NaCN的混合液,CN-的水解常数K=$\frac{{K}_{W}}{{K}_{a}}$=$\frac{1×1{0}^{-14}}{4.9×1{0}^{-10}}$≈2×10-5>4.9×10-10,混合液中CN-的水解程度大于HCN的电离程度,混合液显示碱性,则c(CN-)<c(Na+)<c(HCN);
C.根据表中电离平衡常数可知,HCN的酸性小于H2CO3,HCN不与HCO3-反应;
D.根据等物质的量的Na2CO3、NaHCO3的混合液中的物料守恒判断.
解答 解:A.没有告诉在相同浓度条件下,无法判断5种钠盐溶液pH大小,故A错误;
B.反应所得溶液为等浓度的HCN和NaCN的混合液,CN-的水解常数K=$\frac{{K}_{W}}{{K}_{a}}$=$\frac{1×1{0}^{-14}}{4.9×1{0}^{-10}}$≈2×10-5>4.9×10-10,HCN的电离常数比CN-的水解常数小,混合液中CN-的水解程度大于HCN的电离程度,混合液显示碱性,则c(CN-)<c(Na+)<c(HCN),故B正确;
C.根据电离平衡常数可知,HCN的酸性小于H2CO3,HCN不与HCO3-反应,正确的离子方程式为:HCN+Na2CO3=NaCN+NaHCO3,故C错误;
D.等物质的量的Na2CO3、NaHCO3的混合液中,根据物料守恒可得:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3),故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,根据表中数据正确判断各酸的酸性强弱为解答关键,注意掌握电荷守恒、物料守恒、盐的水解原理在判断离子浓度大小中的应用,试题侧重考查学生的分析、理解能力.

| A. | C2H4Cl2 | B. | C2H3Cl3 | C. | C2HCl3 | D. | C2H2Cl2 |
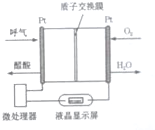
| A. | 电流由O2所在的铂电极流出 | |
| B. | O2所在的铂电极处发生还原反应 | |
| C. | 该电池的负极反应式为CH3CH2OH+3H2O-12e-=2CO2↑+12H+ | |
| D. | 微处理器通过检测电流大小而计算出被测气体中酒精的含量. |
| A. | 冰箱中使用的含氟制冷剂泄露后,会增加空气中的PM2.5 | |
| B. | 节日焰火的五彩缤纷是某些金属单质性质的体现 | |
| C. | 施肥时,农家肥草木灰(有效成分K2CO3)不能与氮肥NH4Cl混合使用 | |
| D. | 化学反应能够制造出新的物质,同时也能制造出新的元素 |
| 物质及其杂质 | 检验 | 除杂 | |
| A | Cl2(HCl) | 湿润的淀粉KI试纸 | 饱和食盐水 |
| B | NO(NO2) | 观察颜色或湿润的淀粉KI试纸 | 水 |
| C | CO2(HCl) | AgNO3溶液(含稀硝酸) | 饱和NaHCO3溶液 |
| D | NaHCO3溶液(Na2CO3) | Ca(OH)2溶液 | 过量CO2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | K+、OH-、Cl-、SO42- | B. | H+、NH4+、Al3+、NO3- | ||
| C. | Na+、S2-、Cl-、SO42- | D. | Na+、C6H5O-、CH3COO-、HCO3- |
| A. | 镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料 | |
| B. | 石英玻璃、陶瓷都属于硅酸盐产品 | |
| C. | 做衣服的棉、麻、蚕丝的成分都是纤维素 | |
| D. | 牛油和花生油在碱性条件下水解产物相同 |
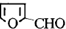 )与丙二酸合成香料过程中发生了
)与丙二酸合成香料过程中发生了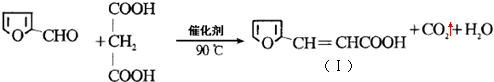
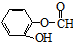 (或
(或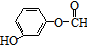 、
、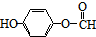 ).
).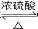 CH3CH2OOCCH2COOCH2CH3+2H2O.
CH3CH2OOCCH2COOCH2CH3+2H2O.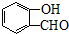 )与丙二酸可发生类似反应①的反应,写出有机产物的结构简式
)与丙二酸可发生类似反应①的反应,写出有机产物的结构简式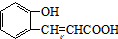 .
.