题目内容
16.下列叙述正确的是( )| A. | 室温下a L稀氨水与b L稀硫酸反应后,溶液pH=7时,c(SO42- )>c(NH4+) | |
| B. | 室温下pH=11的氨水与pH=3的盐酸等体积混合,滴人酚酞溶液呈红色 | |
| C. | 室温下两种醋酸溶液的物质的量浓度分别为c1和c2,pH依次分别为a和a+1,则Cl=l0C2 | |
| D. | 将10 mL 0.1 mol/L Na2CO3溶液逐滴滴加到10mL 0.1 mol/L盐酸中,所得溶液 c(Na+)>c(Cl-)>c(HCO3- )>c(CO32-) |
分析 A.室温下pH=7,则c(H+)=c(OH-),根据混合液中的电荷守恒判断二者浓度大小;
B.氨水为弱碱,两溶液混合后氨水过量,溶液显示碱性;
C.醋酸为弱电解质,浓度越大,醋酸的电离程度越小;
D.碳酸钠滴入盐酸中,滴加过程中碳酸根离子与氢离子结合生成二氧化碳气体,当加入5mL该碳酸钠溶液时,氢离子反应完毕,反应后溶质为0.05mol/L的碳酸钠和0.05mol/L的氯化钠,所以碳酸根离子浓度大于碳酸氢根离子浓度.
解答 解:A.室温下a L稀氨水与b L稀硫酸反应后,溶液pH=7时,则:c(H+)=c(OH-),根据电荷守恒可得:2c(SO42- )=c(NH4+),则c(SO42- )<c(NH4+),故A错误;
B.室温下pH=11的氨水与pH=3的盐酸等体积混合,由于氨水为弱碱,则混合液中氨水过量,溶液呈碱性,故滴人酚酞溶液呈红色,故B正确;
C.醋酸是弱电解质,在水溶液中只有部分电离,所以醋酸的浓度大于氢离子浓度;两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1的两种醋酸溶液中氢离子浓度之比=10:1,当两种酸的电离度相同时,则c1=10c2,实际上,两种酸的浓度不等,且浓度越大,酸的电离度越小,所以两种酸的浓度关系为:c1>10c2,故C错误;
D.将10 mL 0.1 mol/L Na2CO3溶液逐滴滴加到10mL 0.1 mol/L盐酸中,滴加过程中碳酸根离子与氢离子结合生成二氧化碳气体,当加入5mL该碳酸钠溶液时,氢离子反应完毕,反应后溶质为0.05mol/L的碳酸钠和0.05mol/L的氯化钠,碳酸根离子水解程度较小,则c(CO32-)>c(HCO3- ),溶液中正确的离子浓度大小为:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3- ),故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,注意明确弱电解质的电离、盐的水解原理及电荷守恒、物料守恒的含义,D为易错点,注意碳酸钠滴入盐酸中的反应情况,反应后的溶质不是碳酸氢钠和氯化钠溶液,应为碳酸钠和氯化钠.

 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案| 实验 | 除杂试剂 | 实验目的 | |
| ① | 电石与水反应 | CuSO4溶液 | 用KMnO4酸性溶液检验乙炔的还原性 |
| ② | CH3CH2Br与NaOH溶液共热 | HNO3溶液 | 用AgNO3溶液检验CH3CH2Br中的Br |
| ③ | 淀粉与稀H2SO4水浴共热 | NaOH溶液 | 用新制氢氧化铜检验水解产物的还原性 |
| ④ | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | 用Br2的CCl4溶液证明该反应为消去反应 |
| A. | 只有①②③ | B. | 只有①②④ | C. | 只有②③④ | D. | ①②③④ |
②H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H2=-242kJ•mol-1
③2C2H2(g)+5O2(g)=4CO2(g)+2H2O(g)
④2C(s)+H2(g)=C2H2(g)△H4
下列正确的是( )
| A. | 反应①放出197kJ的热量,转移4mol电子 | |
| B. | 反应②可知1mol液态水分解所放出的热量为242kJ | |
| C. | 反应③表示C2H2燃烧热的热化学方程式 | |
| D. | △H4=2△H1+△H2-$\frac{1}{2}$△H3 |
| A. | 标准状况下11.2L乙烯和丙烯的混合气体中含C-H键的数目为2NA | |
| B. | S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA | |
| C. | 0.5mol熔融的NaHSO4中含有的离子数目为1.5NA | |
| D. | 含0.2molH2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1NA |
| A. | 25℃时,pH=11的Na2CO3溶液中水电离出来的H+数目为10-3NA | |
| B. | 78gNa2S和Na2O2的混合物中阴离子的数目为2NA | |
| C. | 在标准状况下,11.2LCCI4分子中氯原子数目为2NA | |
| D. | 室温下,4.4g乙醛和乙酸乙酯的混合物中含有碳原子数目为0.2NA |
| 选项 | ① | ② | ③ | 实验结论 | 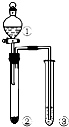 |
| A | NaCl溶液 | 电石 | 酸性KMnO4 | 乙炔具有还原性 | |
| B | 浓硝酸 | Na2CO3 | 苯酚钠溶液 | 酸性:硝酸>碳酸>苯酚 | |
| C | 浓盐酸 | KMnO4 | FeBr2(足量) | 氧化性:Cl2>Br2 | |
| D | 浓硫酸 | 蔗糖 | 溴水 | 浓硝酸具有脱水性、氧化性 |
| A. | A | B. | B | C. | C | D. | D |
 .下列说法正确的是( )
.下列说法正确的是( )| A. | 聚乳酸的相对分子质量是72 | B. | 聚乳酸的分子式是C3H4O2 | ||
| C. | 乳酸的分子式是C3H6O2 | D. | 聚乳酸可以通过水解降解 |

| A. | 分子式为C17H18O3 | |
| B. | M中有4个饱和碳原子 | |
| C. | M可以使溴水和酸性高锰酸钾溶液褪色,但它们的反应类型不同 | |
| D. | 1mol M常温下最多可以与6 mol H2反应 |
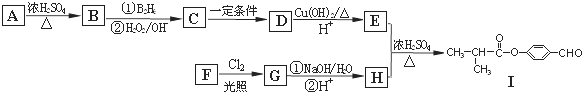
 .
. .E与H反应生成I的方程式为
.E与H反应生成I的方程式为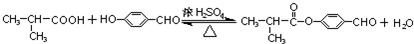 .
.