12.下列有关说法中错误的是( )
| A. | 用NaOH溶液滴定醋酸时,可用酚酞试液作指示剂 | |
| B. | 花生油、菜子油漕油等水解时可得到一种共同的产物 | |
| C. | NH3+HCl=NH4Cl能自发进行,其△H一定小于零 | |
| D. | 甲烷和氯气反应与苯和硝酸反应的反应类型不同 |
11.镍氢电池的应用很广,其正负极材料都可以再生利用,正极主要为氢氧化镍[Ni(OH)2],其表面覆盖有钴或氢氧化钴[Co(OH)2],还含有Fe、Mn、Ca、Mg等杂质元素,现利用以下工艺流程回收正极材料中的Co、Ni元素(部分条件未给出)
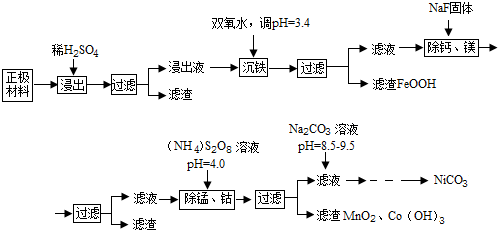
已知:①浸出液中各离子含量
②Ksp(CaF2)=2.7×10-11,Ksp(MgF2)=6.5×10-9,Ksp[Ni(OH)2]=5.5×10-16
回答下列问题:
(1)浸出液沉铁过程中,生成的沉淀是FeOOH,发生反应的离子方程式为2Fe2++H2O2+2H2O=2FeOOH+4H+
(2)加入NaF可除去Ca2+、Mg2+,若使溶液中Ca2+、Mg2+浓度小于1.0×10-5mol/L,F浓度必须大于$\sqrt{\frac{6.5×1{0}^{-9}}{1.0×1{0}^{-5}}}$mol/L(列出计算式即可)
(3)过硫酸铵[(NH4)2S2O8除锰的原理是:第一步用过硫酸铵将溶液中的Mn2+氧化成MnO4-,第二步MnO4-继续与Mn2-反应生成MnO2沉淀,在第一步反应中氧化剂和还原剂的物质的量之比为5:2,第二步发生反应的离子方程式为3Mn2++2MnO4-+2H2O=5MnO2↓+4H+,若除去1L浸出液中的Mn2+和Co2+至少需要过硫酸铵13.68g
(4)除锰、钴时若溶液pH较大,会有什么后果?Ni2+也会形成Ni(OH)2沉淀析出
(5)加入Na2CO3溶液后,为得到纯净的NiCO3固体,需要的操作有过滤、洗涤、干燥.

已知:①浸出液中各离子含量
| 金属离子 | Ni2+ | Co2+ | Fe3+ | Mn2+ | Ca2+ | Mg2+ |
| 浓度(g/L) | 63.6 | 5.90 | 1.00 | 0.22 | 5.24×10-2 | 6.37×10-2 |
回答下列问题:
(1)浸出液沉铁过程中,生成的沉淀是FeOOH,发生反应的离子方程式为2Fe2++H2O2+2H2O=2FeOOH+4H+
(2)加入NaF可除去Ca2+、Mg2+,若使溶液中Ca2+、Mg2+浓度小于1.0×10-5mol/L,F浓度必须大于$\sqrt{\frac{6.5×1{0}^{-9}}{1.0×1{0}^{-5}}}$mol/L(列出计算式即可)
(3)过硫酸铵[(NH4)2S2O8除锰的原理是:第一步用过硫酸铵将溶液中的Mn2+氧化成MnO4-,第二步MnO4-继续与Mn2-反应生成MnO2沉淀,在第一步反应中氧化剂和还原剂的物质的量之比为5:2,第二步发生反应的离子方程式为3Mn2++2MnO4-+2H2O=5MnO2↓+4H+,若除去1L浸出液中的Mn2+和Co2+至少需要过硫酸铵13.68g
(4)除锰、钴时若溶液pH较大,会有什么后果?Ni2+也会形成Ni(OH)2沉淀析出
(5)加入Na2CO3溶液后,为得到纯净的NiCO3固体,需要的操作有过滤、洗涤、干燥.
9.高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.
(1)高锰酸钾溶液应配成中性溶液并保存在棕色试剂瓶中(填保存的注意事项);酸性条件下高锰酸钾溶液分解的离子方程式4MnO4-+4H+═4MnO2↓+3O2↑+2H2O.
(2)请配平高锰酸钾溶液与草酸钠Na2C2O4溶液在酸性条件下反应的离子方程式:MnO4-+C2O42-+H+--Mn2++CO2↑+8H2O
(3)某学习小组为了探究高锰酸钾溶液和草酸钠溶液的反应过程,将高锰酸钾溶液逐滴地滴入一定体积的酸性草酸钠溶液中(温度相同,并不断振荡时),记录的现象如表:
请分析高锰酸钾溶液褪色时间变化的原因反应生成的Mn2+对反应有催化作用,且c(Mn2+)浓度大催化效果更好.
(4)该学习小组在获取了上述经验和结论以后,用稳定的物质草酸钠Na2C2O4(相对分子质量134.0)来标定高锰酸钾溶液的浓度.他们准确称取1.340g纯净的草酸钠配成250mL溶液,每次准确量取25.00mL溶液酸化后用KMnO4溶液滴定.
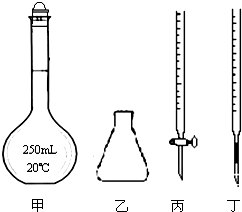
①高锰酸钾溶液应装在丙(填如图中的仪器编号).
②为了防止高锰酸钾在酸性条件下分解而造成误差,滴定时应注意的是逐滴滴入高锰酸钾溶液,待前一滴高锰酸钾溶液颜色褪去后再滴加.
③若在实验过程中存在下列操作,其中会使所测KMnO4浓度偏低的是A.
A.未润洗盛放KMnO4的滴定管
B.滴定前尖嘴部分无气泡,滴定终点时出现气泡
C.定容时,俯视刻度线
D.锥形瓶用水洗之后未用待测液润洗
④当溶液呈微红色且半分钟内不褪色,消耗KMnO4溶液20.00mL(多次测定的平均值),则KMnO4溶液的浓度为0.02mol/L.(附原子相对质量K=39 Mn=55 O=16 Na=23 C=12)

(1)高锰酸钾溶液应配成中性溶液并保存在棕色试剂瓶中(填保存的注意事项);酸性条件下高锰酸钾溶液分解的离子方程式4MnO4-+4H+═4MnO2↓+3O2↑+2H2O.
(2)请配平高锰酸钾溶液与草酸钠Na2C2O4溶液在酸性条件下反应的离子方程式:MnO4-+C2O42-+H+--Mn2++CO2↑+8H2O
(3)某学习小组为了探究高锰酸钾溶液和草酸钠溶液的反应过程,将高锰酸钾溶液逐滴地滴入一定体积的酸性草酸钠溶液中(温度相同,并不断振荡时),记录的现象如表:
滴入高锰酸钾溶液的次序(每滴溶液的体积相同) | 高锰酸钾溶液紫色褪去的时间 |
| 先滴入第1滴 | 1min |
| 褪色后再滴入第2滴 | 15s |
| 褪色后再滴入第3滴 | 3s |
| 褪色后再滴入第4滴 | 1s |
(4)该学习小组在获取了上述经验和结论以后,用稳定的物质草酸钠Na2C2O4(相对分子质量134.0)来标定高锰酸钾溶液的浓度.他们准确称取1.340g纯净的草酸钠配成250mL溶液,每次准确量取25.00mL溶液酸化后用KMnO4溶液滴定.
①高锰酸钾溶液应装在丙(填如图中的仪器编号).
②为了防止高锰酸钾在酸性条件下分解而造成误差,滴定时应注意的是逐滴滴入高锰酸钾溶液,待前一滴高锰酸钾溶液颜色褪去后再滴加.
③若在实验过程中存在下列操作,其中会使所测KMnO4浓度偏低的是A.
A.未润洗盛放KMnO4的滴定管
B.滴定前尖嘴部分无气泡,滴定终点时出现气泡
C.定容时,俯视刻度线
D.锥形瓶用水洗之后未用待测液润洗
④当溶液呈微红色且半分钟内不褪色,消耗KMnO4溶液20.00mL(多次测定的平均值),则KMnO4溶液的浓度为0.02mol/L.(附原子相对质量K=39 Mn=55 O=16 Na=23 C=12)
7.①制备纳米TiO2的方法之一是TiCl4水解生成TiO2•xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2.
②用NaOH测定滤液的浓度:准确称量1.000gNaOH固体质量,配制成250mL溶液,准确量取25.00mL溶液装在锥形瓶,滴加2滴酚酞作指示剂.把滤液装在酸式滴定管中,调节液面排除气泡后,滤液的凹液面刚好在“0”刻度,滴定NaOH溶液,达到终点记录读数.实验重复3次.记录见下表.
(1)TiCl4水解生成TiO2•xH2O的化学方程式为TiCl4+(x+2)H2O=TiO2•xH2O↓+4HCl
(2)配制成250mL溶液使用的量具是250mL容量瓶;
(3)滴定终点的现象是浅红色溶液变为无色,半分钟内不变色.
(4)滤液中溶质的物质的量浓度为0.125mol•L-1.
(5)若在滴定终点读取滴定管刻度时,俯视标准液液面,使对测定结果偏高. (填“偏高”、“偏低”或“无影响”)
②用NaOH测定滤液的浓度:准确称量1.000gNaOH固体质量,配制成250mL溶液,准确量取25.00mL溶液装在锥形瓶,滴加2滴酚酞作指示剂.把滤液装在酸式滴定管中,调节液面排除气泡后,滤液的凹液面刚好在“0”刻度,滴定NaOH溶液,达到终点记录读数.实验重复3次.记录见下表.
| 滴定次数 | NaOH溶液体积/mL | 滴定消耗滤液体积/mL |
| 1 | 25.00 | 20.02 |
| 2 | 25.00 | 17.10 |
| 3 | 25.00 | 19.98 |
(2)配制成250mL溶液使用的量具是250mL容量瓶;
(3)滴定终点的现象是浅红色溶液变为无色,半分钟内不变色.
(4)滤液中溶质的物质的量浓度为0.125mol•L-1.
(5)若在滴定终点读取滴定管刻度时,俯视标准液液面,使对测定结果偏高. (填“偏高”、“偏低”或“无影响”)
5.实验中对某苯的同系物经元素分析测得其分子式为C10H14,经鉴定结构可知分子式中除含苯环外,还含有两个“-CH3”,一个“-CH2-”,一个“CH”,它的可能结构有( )
0 167441 167449 167455 167459 167465 167467 167471 167477 167479 167485 167491 167495 167497 167501 167507 167509 167515 167519 167521 167525 167527 167531 167533 167535 167536 167537 167539 167540 167541 167543 167545 167549 167551 167555 167557 167561 167567 167569 167575 167579 167581 167585 167591 167597 167599 167605 167609 167611 167617 167621 167627 167635 203614
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 2种 |
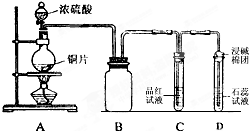 某同学为探究铜跟浓硫酸的反应情况,用如图所示装置进行了有关实验.
某同学为探究铜跟浓硫酸的反应情况,用如图所示装置进行了有关实验. .
.