题目内容
10.有机物X只含C、H、O三种元素,其相对分子质量不超过100,若X中所含氧元素的质量分数为36.36%,则能与NaOH溶液发生反应的X共有(不考虑立体异构)( )| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
分析 根据含氧元素的质量分数为36.36%,相对分子质量不超过100,确定分子中氧原子个数,进而确定有机物的相对分子质量,确定有机物的分子式.根据能与NaOH溶液发生反应说明含有羧基或酯基,确定有机物结构.
解答 解:有机物中氧元素的质量分数为36.36%,相对分子质量不超过100,所以分子中氧原子数目N(O)<$\frac{100×36.36}{16}$≈2.27,故含有O原子个数为2,相对分子质量为:$\frac{16×2}{36.36%}$=88,有机物X由C、H、O三种元素组成,令烃基的组成为-CnHm,烃基的相对分子质量为88-(32+12+1)=43,所以12n+m=43,讨论得到:n=3,m=7符合,故此烃基为:-C3H7,即碳架结构可以是正丙基或异丙基,此时若含有羧基,即为正丁酸或异丁酸,总共有2种;
若为酯基,则可以是:甲酸正丙酯、甲酸异丙酯、乙酸乙酯或丙酸甲酯,此种情况有4种,故总共为6种,
故选B.
点评 本题主要考查的是有机物分子式确定以及同分异构体个数判断,依据含氧量讨论得出该有机物的分子式是解决本题的关键,难度不大.

练习册系列答案
相关题目
19.下列说法中错误的是( )
| A. | NH4H的电子式为: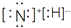 | B. | S2-的离子结构示意图为: | ||
| C. | H2O的形成过程: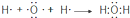 | D. | NaCl的形成过程: |
20.甲、乙、丙、丁四种物质分别含两种或三种元素,它们的分子中各含l8个电子.甲是气态氢化物,在水中分步电离出两种阴离子.下列推断合理的是( )
| A. | 某钠盐溶液含甲电离出的阴离子,则该溶液只能与酸反应 | |
| B. | 丁和甲中各元素质量比相同,则丁中一定含有-l价的元素 | |
| C. | 丙中含有第二周期ⅣA族的元素,则丙一定是只含C、H的化合物 | |
| D. | 乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键 |
5.实验中对某苯的同系物经元素分析测得其分子式为C10H14,经鉴定结构可知分子式中除含苯环外,还含有两个“-CH3”,一个“-CH2-”,一个“CH”,它的可能结构有( )
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 2种 |
15.在100ml,0.1mol•L-1HA的溶液中,c(H+)=0.05mol•L-1,往该溶液中加入等体积浓度的NaOH溶液(忽略溶液混合体积变化),下列离子浓度关系正确的是( )
| A. | c(Na+)>c(A-)>c(H+)>c(OH-) | B. | c(A-)+c(HA)=0.05mol•L-1 | ||
| C. | c(Na+)>c(A-)>c(HA)>c(OH-) | D. | c(HA)+c(H+)=c(A-)+c(OH-) |
2.萘( )的二氯代物有( )
)的二氯代物有( )
 )的二氯代物有( )
)的二氯代物有( )| A. | 8种 | B. | 10种 | C. | 12种 | D. | 14种 |
20.短周期元素X、Y、Z在元素周期表中的位置如图,已知X与Y的原子序数之和等于Z的原子序数.下列说法错误的是( )
| X | Y | |
| Z |
| A. | Y的气态氢化物比X的最简单气态氢化物的稳定性高 | |
| B. | 在X、Y、Z三种元素中,只有X的最高价氧化物对应的水化物与它的气态氢化物可以反应生成盐 | |
| C. | 由X、Y、Z分别形成的单质,常温下Z单质的沸点最高 | |
| D. | 在标准状况下,1molY 的氢化物的体积约为22.4L |
 .
. .
.