题目内容
6.利用明矾石(主要成分:K2SO4•Al2(SO4)3•2Al2O3•6H2O,少量杂质Fe2O3)制备氢氧化铝的流程如图所示:
(1)焙烧炉中反应为:2Al2(SO4)3+3S═2Al2O3+9SO2; 该反应的氧化剂及被氧化的元素分别是:Al2(SO4)3;若生成1mol Al2O3,则转移电子数是3.612×1024个;
(2)熟料溶解时的离子方程式:Al2O3+2OH-=2AlO2-+H2O.
(3)检验废渣中含有Fe2O3所需的试剂:HCl、KSCN.所观察到的现象为溶液显血红色
(4)母液中溶质的主要成分的化学式为:K2SO4、Na2SO4;溶液调节pH后经过滤、洗涤可得Al(OH)3沉淀,证明沉淀洗涤干净的实验操作和现象是:取最后一次的洗涤液于试管中,加入BaCl2溶液,无白色沉淀产生,证明洗涤干净.
分析 由制备流程可知,明矾石脱水后,在焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S$\frac{\underline{\;高温\;}}{\;}$2Al2O3+9SO2,得到的炉气主要为SO2,熟料中含K2SO4、Al2O3及少量的Fe2O3,然后加NaOH、H2O溶解时,发生Al2O3+2OH-=2AlO2-+H2O,废渣中含Fe2O3,溶液中含K2SO4、NaAlO2、Na2SO4,最后加硫酸条件pH,AlO2-转化为Al(OH)3,母液中离子主要有K+、Na+、SO42-,含有溶质为K2SO4、Na2SO4,以此来解答.
解答 解:由制备流程可知,明矾石脱水后,在焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S$\frac{\underline{\;高温\;}}{\;}$2Al2O3+9SO2,得到的炉气主要为SO2,熟料中含K2SO4、Al2O3及少量的Fe2O3,然后加NaOH、H2O溶解时,发生Al2O3+2OH-=2AlO2-+H2O,废渣中含Fe2O3,溶液中含K2SO4、NaAlO2、Na2SO4,最后加硫酸条件pH,AlO2-转化为Al(OH)3,母液中离子主要有K+、Na+、SO42-,含有溶质为K2SO4、Na2SO4,
(1)反应中Al2(SO4)3→SO2,硫元素化合价由+6价降低为+4价,故Al2(SO4)3是氧化剂,反应中硫单质中硫元素化合价由0价升高为SO2中+4价,硫单质为还原剂,生成1molAl2O3需要硫的物质的量为1mol×$\frac{3}{2}$=1.5mol,转移电子的物质的量为1.5mol×4=6mol,转移电子数目为6mol×6.02×1023mol-1=3.612×1024,
故答案为:Al2(SO4)3;3.612×1024;
(2)由工艺流程可知,熟料溶解为氧化铝与氢氧化钠溶液反应生成偏铝酸钠,离子方程式为Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O;
(3)因含铁离子的溶液加KSCN溶液变为血红色可检验铁离子,选择HCl溶解固体,KSCN检验铁离子,则检验废渣中含有Fe2O3所需的试剂为HCl、KSCN,
故答案为:HCl、KSCN;溶液显血红色;
(4)由上述分析可知,加硫酸调pH值时,AlO2-转化为Al(OH)3,母液中离子主要有K+、Na+、SO42-,含有溶质为K2SO4、Na2SO4;沉淀洗涤干净则表面不含硫酸根离子,沉淀洗涤干净的实验操作和现象是取最后一次的洗涤液于试管中,加入BaCl2溶液,无白色沉淀产生,证明洗涤干净,
故答案为:K2SO4、Na2SO4;取最后一次的洗涤液于试管中,加入BaCl2溶液,无白色沉淀产生,证明洗涤干净.
点评 本题考查制备实验方案的设计,为高频考点,把握制备流程中的反应、混合物分离提纯方法为解答的关键,注意离子反应、氧化还原反应及离子检验的综合应用,侧重分析、实验能力的考查,题目难度中等.

 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案| A. | NaHSO4熔化时,离子键和共价键均被破坏 | |
| B. | 过氧化氢中只有非极性共价键 | |
| C. | 金属元素与非金属元素化合时,一定形成离子键 | |
| D. | 非金属元素也可能形成离子键 |
| A. | HCl具有很强的酸性,所以氯元素的非金属性很强 | |
| B. | ${\;}_{17}^{35}$Cl、${\;}_{17}^{37}$Cl为不同的核素,有不同的化学性质 | |
| C. | 1.12LCl2含有1.7NA个质子(NA 表示阿伏加德罗常数) | |
| D. | 氯气可从KI溶液中置换出I2,说明氯的非金属性比碘强 |
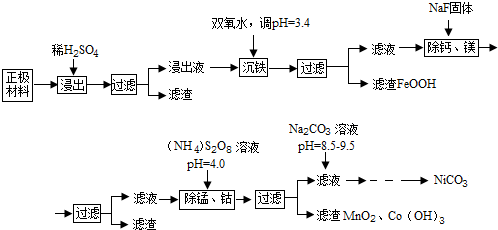
已知:①浸出液中各离子含量
| 金属离子 | Ni2+ | Co2+ | Fe3+ | Mn2+ | Ca2+ | Mg2+ |
| 浓度(g/L) | 63.6 | 5.90 | 1.00 | 0.22 | 5.24×10-2 | 6.37×10-2 |
回答下列问题:
(1)浸出液沉铁过程中,生成的沉淀是FeOOH,发生反应的离子方程式为2Fe2++H2O2+2H2O=2FeOOH+4H+
(2)加入NaF可除去Ca2+、Mg2+,若使溶液中Ca2+、Mg2+浓度小于1.0×10-5mol/L,F浓度必须大于$\sqrt{\frac{6.5×1{0}^{-9}}{1.0×1{0}^{-5}}}$mol/L(列出计算式即可)
(3)过硫酸铵[(NH4)2S2O8除锰的原理是:第一步用过硫酸铵将溶液中的Mn2+氧化成MnO4-,第二步MnO4-继续与Mn2-反应生成MnO2沉淀,在第一步反应中氧化剂和还原剂的物质的量之比为5:2,第二步发生反应的离子方程式为3Mn2++2MnO4-+2H2O=5MnO2↓+4H+,若除去1L浸出液中的Mn2+和Co2+至少需要过硫酸铵13.68g
(4)除锰、钴时若溶液pH较大,会有什么后果?Ni2+也会形成Ni(OH)2沉淀析出
(5)加入Na2CO3溶液后,为得到纯净的NiCO3固体,需要的操作有过滤、洗涤、干燥.
| 物理量 编号 | V(0.20mol/L H2C2O4溶液)/mL | 甲 | V(O.O1mol/L KMnO4溶液)/mL | M(MnSO4固体)/g | T/℃ | 乙 |
| ① | 2.0 | 0 | 4.0 | 0 | 5.0 | |
| ② | 2.0 | 0 | 4.0 | 0 | 2.5 | |
| ③ | 1.0 | a | 4.0 | 0 | 2.5 | |
| ④ | 2.0 | 0 | 4.0 | 0.1 | 2.5 |
(1)完成上述反应原理的离子反应方程式
□MnO4-+□5H2C2O2+□6H+=□Mn2-+□CO2↑+□H2
(2)上述实验①②是温度探究对化学反应速率的影响;若上述实验②③是探究浓度对化学反应速率的影响,则表格中“甲”应填写V(蒸馏水)/mL,a为1.0;乙是实验需要测量的物理量,则表格中“乙”应填
写溶液褪色的时间
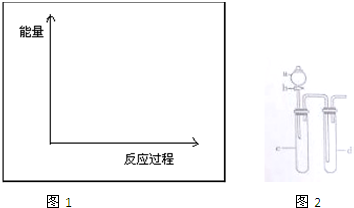
(3)上述实验②④是探究催化剂对化学反应速率的影响,请在答题卷的坐标图1中画出②和④的能量变化关系图(做必要的标注)
Ⅱ某化学小组利用图2装置进行实验证明氧化性;KMnO4>Cl2>Br2,限选试剂:KBr溶液、KMnO4.浓盐酸、浓硫酸
(4)装置a、d中盛放的试剂分别是:浓盐酸、KBr溶液;试验中观察到的现象为c中有黄绿色气体产生,d中溶液变为棕黄色;此实验装置的不足之处是无尾气处理装置
| A. | 该反应的氧化剂只有CuSO4 | |
| B. | SO42-既不是氧化产物也不是还原产物 | |
| C. | 1mol CuS04 还原了$\frac{1}{4}$mol S | |
| D. | 被还原的S和被氧化的S的质量比为7:3 |
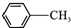 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$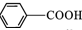

 .
.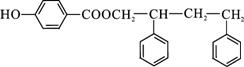 .
.