题目内容
9.高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.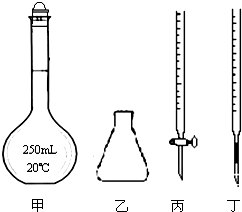
(1)高锰酸钾溶液应配成中性溶液并保存在棕色试剂瓶中(填保存的注意事项);酸性条件下高锰酸钾溶液分解的离子方程式4MnO4-+4H+═4MnO2↓+3O2↑+2H2O.
(2)请配平高锰酸钾溶液与草酸钠Na2C2O4溶液在酸性条件下反应的离子方程式:MnO4-+C2O42-+H+--Mn2++CO2↑+8H2O
(3)某学习小组为了探究高锰酸钾溶液和草酸钠溶液的反应过程,将高锰酸钾溶液逐滴地滴入一定体积的酸性草酸钠溶液中(温度相同,并不断振荡时),记录的现象如表:
滴入高锰酸钾溶液的次序(每滴溶液的体积相同) | 高锰酸钾溶液紫色褪去的时间 |
| 先滴入第1滴 | 1min |
| 褪色后再滴入第2滴 | 15s |
| 褪色后再滴入第3滴 | 3s |
| 褪色后再滴入第4滴 | 1s |
(4)该学习小组在获取了上述经验和结论以后,用稳定的物质草酸钠Na2C2O4(相对分子质量134.0)来标定高锰酸钾溶液的浓度.他们准确称取1.340g纯净的草酸钠配成250mL溶液,每次准确量取25.00mL溶液酸化后用KMnO4溶液滴定.
①高锰酸钾溶液应装在丙(填如图中的仪器编号).
②为了防止高锰酸钾在酸性条件下分解而造成误差,滴定时应注意的是逐滴滴入高锰酸钾溶液,待前一滴高锰酸钾溶液颜色褪去后再滴加.
③若在实验过程中存在下列操作,其中会使所测KMnO4浓度偏低的是A.
A.未润洗盛放KMnO4的滴定管
B.滴定前尖嘴部分无气泡,滴定终点时出现气泡
C.定容时,俯视刻度线
D.锥形瓶用水洗之后未用待测液润洗
④当溶液呈微红色且半分钟内不褪色,消耗KMnO4溶液20.00mL(多次测定的平均值),则KMnO4溶液的浓度为0.02mol/L.(附原子相对质量K=39 Mn=55 O=16 Na=23 C=12)
分析 (1)由题目信息可知,高锰酸钾溶液在酸性、碱性条件下都会分解,且见光分解速度加快,故应避光保存配成中性溶液;
由题目信息可知,高锰酸钾在酸性条件下会分解生成二氧化锰和氧气,同时会生成水,据此书写离子方程式;
(2)根据化合价升降方法,反应中MnO4-→Mn2+,锰元素化合价由+7价降低为+2价,共降低5价,C2O42-→CO2,碳元素化合价由+3价升高为+4,共升高2价,化合价最小公倍数为10,故MnO4-系数为2,C2O42-系数为5,再根据元素守恒、电荷守恒确定其它物质的系数;
(3)反应中Mn2+浓度发生显著变化,应是反应生成的Mn2+对反应有催化作用,且c(Mn2+)浓度大催化效果更好;
(4)①高锰酸钾具有强氧化性,可以发生碱式滴定管的橡皮管,故应用酸式滴定管盛放;
②逐滴滴入高锰酸钾溶液,待前一滴高锰酸钾溶液颜色褪去后再滴加,防止高锰酸钾在酸性条件下分解;
③依据消耗标准溶液的体积分析判断选项,c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$;
④令KMnO4溶液的浓度为c,根据方程式2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O计算.
解答 解:(1)由题目信息可知,高锰酸钾溶液在酸性、碱性条件下都会分解,且见光分解速度加快,故应盛放在棕色瓶中避光保存配成中性溶液;
由题目信息可知,高锰酸钾在酸性条件下会分解生成二氧化锰和氧气,同时会生成水,反应离子方程式为4MnO4-+4H+═4MnO2↓+3O2↑+2H2O,
故答案为:配成中性溶液并保存在棕色试剂瓶中;4MnO4-+4H+═4MnO2↓+3O2↑+2H2O;
(2)反应中MnO4-→Mn2+,锰元素化合价由+7价降低为+2价,共降低5价,C2O42-→CO2,碳元素化合价由+3价升高为+4,共升高2价,化合价最小公倍数为10,故MnO4-系数为2,C2O42-系数为5,再根据元素守恒可知Mn2+系数为2、CO2系数为10,根据电荷守恒可知H+系数为16,根据氢元素守恒可知H2O系数为8,配平后离子方程式为2MnO4-+5C2O42-+16H+=2Mn2++10CO2+8H2O,
故答案为:2;5;16;2;10;8H2O;
(3)反应中Mn2+浓度发生显著变化,应是反应生成的Mn2+对反应有催化作用,且c(Mn2+)浓度大催化效果更好,
故答案为:反应生成的Mn2+对反应有催化作用,且c(Mn2+)浓度大催化效果更好;
(4)①高锰酸钾具有强氧化性,可以发生碱式滴定管的橡皮管,故应用酸式滴定管盛放,故选择丙,故答案为:丙;
②防止高锰酸钾在酸性条件下分解,滴定时应逐滴滴入高锰酸钾溶液,待前一滴高锰酸钾溶液颜色褪去后再滴加,
故答案为:逐滴滴入高锰酸钾溶液,待前一滴高锰酸钾溶液颜色褪去后再滴加;
③用稳定的物质草酸钠Na2C2O4(相对分子质量134.0)来标定高锰酸钾溶液的浓度,c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$;
A.盛装KMnO4溶液的滴定管用水洗后,未用KMnO4溶液润洗,高锰酸钾溶液被稀释,高锰酸钾的物质的量偏小,测定的高锰酸钾的浓度偏低,故A符合;
B.滴定前尖嘴部分无气泡,滴定终点时出现气泡,导致高锰酸钾溶液的体积偏小,测定的高锰酸钾的浓度偏大,故B不符合;
C.定容时,俯视刻度线,导致高锰酸钾溶液的体积偏小,测定的高锰酸钾的浓度偏大,故C不符合;
D.锥形瓶用蒸馏水洗净后未用待测液润洗,对草酸的物质的量没有影响,故对测定的高锰酸钾的浓度无影响,故D不符合;
故答案为:A;
④n(C2O42-)=$\frac{1.34g}{134g/mol}$=0.01mol,则:
2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O计
2mol 5mol
c×0.02L×10 0.01mol
所以2mol:5mol=c×0.02L×10:0.01mol
解得c=0.02mol/L
故答案为:0.02mol/L.
点评 本题考查药品存放、氧化还原反应配平、氧化还原反应滴定应用、化学计算等,题目难度中等,注意把握实验的原理,需要学生具备一定的理论分析能力和计算解决问题的能力.

 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案①微粒半径:Cl>S>P
②氢化物的稳定性:HF>HCl>HBr
③离子的还原性:Cl->Br->I-
④氧化性:S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4
⑥非金属性:F>Cl>Br.
| A. | ②④⑥ | B. | ①③④ | C. | ①②⑤ | D. | ②⑤⑥ |
| A. | W、Y的原子序数a>c | B. | 离子的还原性Y2-<Z- | ||
| C. | 原子最外层电子数Y<W | D. | 离子半径X+>Z- |
| A. | 动物油加入稀硫酸生产肥皂 | |
| B. | 天然气、液化石油气的成分相同 | |
| C. | 乙烯和乙醛都能发生加成反应 | |
| D. | 石油裂解和蔗糖水解都是由高分子生成小分子的过程 |

| A. |  有五种同分异构体 有五种同分异构体 | B. |  与BHT互为同系物 与BHT互为同系物 | ||
| C. | BHT具有还原性不能发生还原反应 | D. | 两种方法的反应类型都是加成反应 |
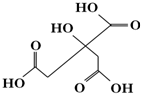
| A. | X分子式为C6H6O7 | |
| B. | 1 mol物质X可以和3 mol氢气发生加成 | |
| C. | X分子不可以发生消去反应 | |
| D. | 足量的X分别与等物质的量的NaHCO3、Na2CO3反应得到的气体物质的量相同 |
 重大节日为保证鲜花盛开,对大量盆栽鲜花施用了S=诱抗素制剂.S-诱抗素的分子结构如图所示.下列关于该物质的说法正确的是( )
重大节日为保证鲜花盛开,对大量盆栽鲜花施用了S=诱抗素制剂.S-诱抗素的分子结构如图所示.下列关于该物质的说法正确的是( )| A. | 该有机物的分子式为C15H22O4 | |
| B. | 1mol该有机物与足量Na反应生成1molH2 | |
| C. | 该有机物能发生取代、加成和水解反应 | |
| D. | 1mol该有机物与足量溴反应最多消耗4molBr2 |

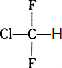 .
. ;,反应类型是加聚反应.
;,反应类型是加聚反应.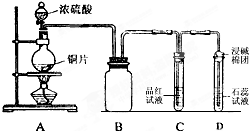 某同学为探究铜跟浓硫酸的反应情况,用如图所示装置进行了有关实验.
某同学为探究铜跟浓硫酸的反应情况,用如图所示装置进行了有关实验.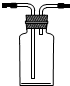 .
.