1. 浓硫酸与少量铜片反应的实验,下列是对实验操作、实验现象或解释等的有关记录,其中与事实不符或解释不合理的是( )
浓硫酸与少量铜片反应的实验,下列是对实验操作、实验现象或解释等的有关记录,其中与事实不符或解释不合理的是( )
 浓硫酸与少量铜片反应的实验,下列是对实验操作、实验现象或解释等的有关记录,其中与事实不符或解释不合理的是( )
浓硫酸与少量铜片反应的实验,下列是对实验操作、实验现象或解释等的有关记录,其中与事实不符或解释不合理的是( )| A. | 实验开始时需给a试管稍微加热 | |
| B. | 反应开始时铜片表面可以看到有黑色物质生成 | |
| C. | 将a试管里的溶液冷却后注入盛有水的烧杯中,溶液呈蓝色 | |
| D. | b试管中的溶液逐渐褪为无色,说明反应生成的气体,将品红氧化为无色 |
15.对下列有关物质同分异构体(不考虑立体异构)数目的分析中正确的是( )
| 选项 | 分子式 | 限定条件 | 数目 |
| A | C2H4O2 | 能与Na2CO3溶液反应 | 2 |
| B | C4H8Cl2 | 分子中有一个甲基 | 3 |
| C | C4H10O | 不能与钠反应 | 2 |
| D | C8H10 | 含有苯环 | 3 |
| A. | A | B. | B | C. | C | D. | D |
14.某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子组成HmX分子.在a g HmX中所含质子的物质的量是( )
| A. | a×(A-N+m)/(A+m)mol | B. | a×(A-N)/Amol | C. | a×(A-N)/(A+m)mol | D. | a×(A-N+m)/Amol |
13.氨基呈碱性,氨基酸呈两性,把甘氨酸(氨基乙酸)放入一定pH的溶液中,所得溶液中不能同时大量存在的微粒是( )
①H2NCH2COOH ②H3N+-CH2COOH ③H2NCH2COO- ④H3N+-CH2COO-.
①H2NCH2COOH ②H3N+-CH2COOH ③H2NCH2COO- ④H3N+-CH2COO-.
| A. | ①与② | B. | ①与③ | C. | ②与③ | D. | ②与④ |
12.某甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸、和水等,某同学为了检验产品中的苯甲酸和硫酸,做了如下实验.(已知H2SO3:K1=1.3×10-2 K2=6.3×10-8,苯甲酸:Ka=6.46×10-5,碳酸;K1=4.30×10-7 K2=5.61×10-11)限选试剂:0.1 mol•L-1BaCl2溶液,0.1 mol•L-1Ba(OH)2溶液,1.0 mol•L-1Na2CO3溶液,1.0mol•L-1NaHCO3溶液,1 mol•L-1HCl溶液,1 mol•L-1Na2SO3溶液,1 mol•L-1NaHSO3溶液.
| 实验操作 | 实验现象及结论 |
| ①取粗产品于试管中,加入1.0 mol•L-1Na2CO3溶液,酯溶解度减小振荡分层,用分液漏斗分液,得到水层加入0.1 mol•L-1BaCl2溶液 | 白色沉淀生成,说明含有硫酸 |
| ②取①反应后的溶液于试管中,加入1 mol•L-1HCl溶液 | 出现白色晶体,证明含有苯甲酸 |
11.同一温度下,A物质10g溶于50g水中成饱和溶液,B物质的饱和溶液的质量分数为30%,C物质的溶质分别蒸发10g水,第一次析出2g晶体,第二次析出4g晶体,则A、B、C三种物质的溶解度大小顺序为( )
| A. | A>B>C | B. | A<B<C | C. | C>A>B | D. | B>C>A |
10.现有8中元素的性质、数据如下表所列,它们属于第二或第三周期
回答下列问题:(用元素符号或化学式填写)
(1)②的元素符号是Be;③的元素名称是硼;①在元素周期表中的位置是(周期,族)第二周期ⅥA族;⑧的离子结构示意图:
(2)比较⑤和⑥的最高价氧化物对应水化物的酸性大小:HClO4>HNO3;
(3)比较⑥和⑦的氢化物的稳定性:NH3>SiH4;⑥的氢化物电子式为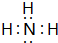 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”);
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”);
(4)写出⑥的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:NH3+HNO3=NH4HNO3
(5)写出⑧的最高价氧化物对应水化物跟短周期中碱性最强的氢氧化物反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(6)④的氢化物与⑤的单质(体积比为1:2)在光照条件下反应,生成的有机产物有4种,其中常温下是气体的是CH3Cl,含有4个相同极性键的是CCl4.
| 元素性质 编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 0.89 | 0.82 | 0.77 | 0.99 | 0.75 | 1.17 | 1.43 |
| 最高或最低化合价 | +2 | +3 | +4 | +7 | +5 | +4 | +3 | |
| -2 | -4 | -1 | -3 | -4 |
(1)②的元素符号是Be;③的元素名称是硼;①在元素周期表中的位置是(周期,族)第二周期ⅥA族;⑧的离子结构示意图:

(2)比较⑤和⑥的最高价氧化物对应水化物的酸性大小:HClO4>HNO3;
(3)比较⑥和⑦的氢化物的稳定性:NH3>SiH4;⑥的氢化物电子式为
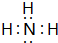 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”);
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”);(4)写出⑥的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:NH3+HNO3=NH4HNO3
(5)写出⑧的最高价氧化物对应水化物跟短周期中碱性最强的氢氧化物反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(6)④的氢化物与⑤的单质(体积比为1:2)在光照条件下反应,生成的有机产物有4种,其中常温下是气体的是CH3Cl,含有4个相同极性键的是CCl4.
8.某种合金的晶胞结构如图所示,则下列说法正确的是( )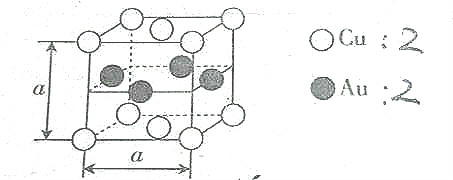
0 167408 167416 167422 167426 167432 167434 167438 167444 167446 167452 167458 167462 167464 167468 167474 167476 167482 167486 167488 167492 167494 167498 167500 167502 167503 167504 167506 167507 167508 167510 167512 167516 167518 167522 167524 167528 167534 167536 167542 167546 167548 167552 167558 167564 167566 167572 167576 167578 167584 167588 167594 167602 203614

| A. | 该合金属于离子晶体 | B. | 该合金中Au的配位数是4 | ||
| C. | 该合金中Cu的配位数是8, | D. | 该合金的硬度低于Cu |



