题目内容
16.指出下列反应中被氧化和被还原的元素,氧化剂和还原剂,氧化产物和还原产物.(1)4HCl+MnO2$\stackrel{△}{→}$MnCl2+2H2O+Cl2↑
(2)2HCl+Zn→ZnCl2+H2↑
分析 含元素化合价升高的物质为还原剂,被氧化,对应的产物为氧化产物;含元素化合价降低的为氧化剂,被还原,对应的产物为还原产物,以此解答.
解答 解:(1)反应4HCl+MnO2$\stackrel{△}{→}$MnCl2+2H2O+Cl2↑中,Cl元素化合价升高,被氧化,HCl为还原剂,Cl2为氧化产物,Mn元素化合价降低,被还原,MnO2为氧化剂,MnCl2为还原产物,
答:被氧化的元素为Cl,被还原的元素为Mn,氧化剂为MnO2,还原剂为HCl,氧化产物为Cl2,还原产物为MnCl2;
(2)反应2HCl+Zn→ZnCl2+H2↑中,H元素化合价降低,被还原,HCl为氧化剂,Zn元素化合价升高,被氧化,Zn为还原剂,ZnCl2为氧化产物,H2为还原产物,
答:被氧化的元素为Zn,被还原的元素为H,HCl为氧化剂,还原剂为Zn,ZnCl2为氧化产物,H2为还原产物.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,注意从化合价角度分析,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.已知Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=2.5×10-9.若用10L Na2CO3溶液溶解1.0mol的BaSO4则Na2CO3溶液的最初浓度不得低于( )
| A. | 2.6 mol/L | B. | 2.5 mol/L | C. | 2.3 mol/L | D. | 3.0 mol/L |
11.同一温度下,A物质10g溶于50g水中成饱和溶液,B物质的饱和溶液的质量分数为30%,C物质的溶质分别蒸发10g水,第一次析出2g晶体,第二次析出4g晶体,则A、B、C三种物质的溶解度大小顺序为( )
| A. | A>B>C | B. | A<B<C | C. | C>A>B | D. | B>C>A |
9.下列物质属于等电子体一组的是( )
| A. | CO2和NO2 | B. | B3H6N3和C6H6 | C. | CH4和NH4+ | D. | H2O和CH4 |
10.常温下,将NO和O2两种气体按物质的量1:3混合,则其平均相对分子质量是( )
| A. | 40.7 | B. | 46 | C. | 36 | D. | 44 |
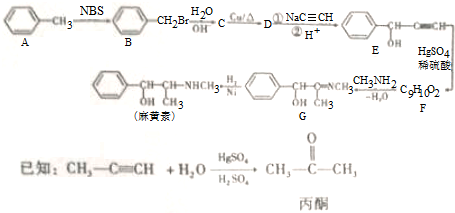

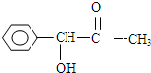 ,H是F的同分异构体,H中含有苯环,苯环上只有两个取代基,并且能发生水解反应,则H的可能结构有12种,其中核磁共振氢谱显示有四组峰的结构简式为(任写~种)
,H是F的同分异构体,H中含有苯环,苯环上只有两个取代基,并且能发生水解反应,则H的可能结构有12种,其中核磁共振氢谱显示有四组峰的结构简式为(任写~种) 或
或 .
.