题目内容
13.氨基呈碱性,氨基酸呈两性,把甘氨酸(氨基乙酸)放入一定pH的溶液中,所得溶液中不能同时大量存在的微粒是( )①H2NCH2COOH ②H3N+-CH2COOH ③H2NCH2COO- ④H3N+-CH2COO-.
| A. | ①与② | B. | ①与③ | C. | ②与③ | D. | ②与④ |
分析 中性溶液中可以存在①H2NCH2COOH,还可以存在H3N+-CH2COOH、③H2NCH2COO-;
强酸性溶液中甘氨酸中氨基与氢离子反应生成H3N+-CH2COoH,不可能大量存在③H2NCH2COO-;
强碱性溶液中,甘氨酸中的羧基与氢氧根离子反应生成③H2NCH2COO-,不可能大量存在②H3N+-CH2COOH,
据此进行判断.
解答 解:A.①H2NCH2COOH和②H3N+-CH2COOH在弱酸性溶液中可以大量存在,故A错误;
B.①H2NCH2COOH、③H2NCH2COO-在弱碱性溶液中可以大量存在,故B错误;
C.强酸性溶液中存在大量的②H3N+-CH2COOH,强碱性溶液中存在大量的③H2NCH2COO-,二者不可能大量存在于同一溶液中,故C正确;
D.②H3N+-CH2COOH、④H3N+-CH2COO-在弱碱性溶液中可以大量存在,故D错误;
故选C.
点评 本题考查了离子共存的判断,题目难度中等,明确氨基酸的组成及性质为解答关键,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.分子式为C6H12O2且与NaHCO3反应放出CO2的有机化合物有(不考虑立体结构)( )
| A. | 8种 | B. | 7种 | C. | 6种 | D. | 5种 |
4.BaSO4饱和溶液中加少量的BaCl2溶液产生BaSO4沉淀,若以Ksp表示BaSO4的溶度积常数,则平衡后溶液中( )
| A. | c (Ba2+)=c(SO42-)=(Ksp)${\;}^{\frac{1}{2}}$ | B. | c(Ba2+)•c(SO42-)>Ksp,c(Ba2+)=c(SO42-) | ||
| C. | c(Ba2+)•c(SO42-)=Ksp,c(Ba2+)>c(SO42-) | D. | c(Ba2+)•c(SO42-)≠Ksp,c(Ba2+)<c(SO42-) |
8.某种合金的晶胞结构如图所示,则下列说法正确的是( )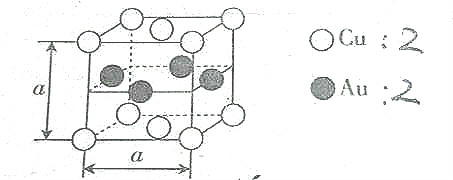

| A. | 该合金属于离子晶体 | B. | 该合金中Au的配位数是4 | ||
| C. | 该合金中Cu的配位数是8, | D. | 该合金的硬度低于Cu |
2.现有200mL MgCl2和AlCl3的混合溶液,其中c(Mg2+)=0.2mol•L-1,c(Cl-)=1.3mol•L-1,要使Mg2+转化为Mg(OH)2,并使与Al3+分开,至少需要4mol•L-1的NaOH溶液的体积为( )
| A. | 140 mL | B. | 120 mL | C. | 100 mL | D. | 80 mL |
 利用如图装置可验证酸的强弱规律.
利用如图装置可验证酸的强弱规律.