6.下列关于苯的说法中,正确的是( )
| A. | 试管中加入少量苯,加入溴水振荡后,溴水褪色,发生了加成反应 | |
| B. | 苯能使酸性高锰酸钾溶液褪色 | |
| C. | 苯较难发生加成反应,所以通常要加入催化剂 | |
| D. | 苯不能发生取代反应 |
5.误食重金属盐会使人中毒,可用于解毒的急救措施是( )
| A. | 服大量食盐水 | B. | 服鸡蛋清或牛奶 | C. | 服泻药 | D. | 服葡萄糖水 |
4.下列说法正确的是( )
| A. | SiO2是酸性氧化物,能与溶液反应 | |
| B. | Na2CO3和NaHCO3都是盐,都能与CaCl2溶液反应 | |
| C. | CO和NO都是大气污染物,在空气中都能稳定存在 | |
| D. | Al在浓盐酸中会“钝化”,能用铝槽盛放浓盐酸 |
1.下列是A、B、C、D、E五种短周期元素的某些性质:
(1)A原子的核外电子排布的轨道表示式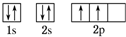 C原子的价电子排布式3s23p5
C原子的价电子排布式3s23p5
(2)A、B、C、G对应的最高价氧化物的水化物酸性最强的是HClO4(写化学式).
(3)相同条件下,AD2与BD2分子在水中的溶解度较大的是SO2(写化学式),理由是CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”,SO2在H2O中的溶解度较大.
(4)A、B、D形成的氢化物沸点:H2O更高,热稳定性H2O更强.(写化学式)
(5)根据等电子原理(化学通式相同且价电子总数相等的分子或离子,结构相似),写出AD分子的结构式C≡O.
(6)已知AG-与G2结构相似,推算HAG分子中σ键与π键数目之比为1:1.
| A | B | C | D | E | G | |
| 最低化合价 | -4 | -2 | -1 | -2 | -1 | -3 |
| 电负性 | 2.55 | 2.58 | 3.16 | 3.44 | 3.98 | 3.0 |
 C原子的价电子排布式3s23p5
C原子的价电子排布式3s23p5(2)A、B、C、G对应的最高价氧化物的水化物酸性最强的是HClO4(写化学式).
(3)相同条件下,AD2与BD2分子在水中的溶解度较大的是SO2(写化学式),理由是CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”,SO2在H2O中的溶解度较大.
(4)A、B、D形成的氢化物沸点:H2O更高,热稳定性H2O更强.(写化学式)
(5)根据等电子原理(化学通式相同且价电子总数相等的分子或离子,结构相似),写出AD分子的结构式C≡O.
(6)已知AG-与G2结构相似,推算HAG分子中σ键与π键数目之比为1:1.
19.下表列出了前20号元素中的某些元素性质的有关数据:
试回答下列问题:
(1)以上10种元素的原子中,最容易失去电子的是②(填写编号);与H2最容易化合的非金属单质是氟气(写物质名称).
(2)写出元素⑤的氢化物结构式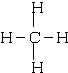 ;③和⑤形成的化合物的电子式
;③和⑤形成的化合物的电子式 ;写出元素③和⑧形成的既有离子键,又有共价键的化合物的电子式
;写出元素③和⑧形成的既有离子键,又有共价键的化合物的电子式 ;
;
(3)某元素R的原子半径为1.02×10-10m,该元素在周期表中的位置第三周期第VIA族.
(4)写出上述⑥、⑦两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的一种物质的分子式PCl3.
(5)试比较⑤和⑨两元素的最高价氧化物对应的水化物的酸性强弱(填化学式):HClO4>HNO3
(6)写出④的最高价氧化物分别跟⑦和⑧的最高价氧化物的水化物反应的离子方程式OH-+Al(OH)3=AlO2-+2H2O,Al(OH)3+3H+=Al3++3H2O.
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径 (10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | -- | +3 | +4 | +5 | +7 | +1 | +5 | -- |
| 最低价态 | -- | -- | -2 | -- | -4 | -3 | -1 | -- | -3 | -1 |
(1)以上10种元素的原子中,最容易失去电子的是②(填写编号);与H2最容易化合的非金属单质是氟气(写物质名称).
(2)写出元素⑤的氢化物结构式
 ;③和⑤形成的化合物的电子式
;③和⑤形成的化合物的电子式 ;写出元素③和⑧形成的既有离子键,又有共价键的化合物的电子式
;写出元素③和⑧形成的既有离子键,又有共价键的化合物的电子式 ;
;(3)某元素R的原子半径为1.02×10-10m,该元素在周期表中的位置第三周期第VIA族.
(4)写出上述⑥、⑦两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的一种物质的分子式PCl3.
(5)试比较⑤和⑨两元素的最高价氧化物对应的水化物的酸性强弱(填化学式):HClO4>HNO3
(6)写出④的最高价氧化物分别跟⑦和⑧的最高价氧化物的水化物反应的离子方程式OH-+Al(OH)3=AlO2-+2H2O,Al(OH)3+3H+=Al3++3H2O.
18.下列关于苯酚的叙述中,错误的是( )
0 167399 167407 167413 167417 167423 167425 167429 167435 167437 167443 167449 167453 167455 167459 167465 167467 167473 167477 167479 167483 167485 167489 167491 167493 167494 167495 167497 167498 167499 167501 167503 167507 167509 167513 167515 167519 167525 167527 167533 167537 167539 167543 167549 167555 167557 167563 167567 167569 167575 167579 167585 167593 203614
| A. | 其水溶液显酸性,俗称石碳酸 | |
| B. | 其浓溶液对皮肤有强烈的腐蚀性,如果不慎沾在皮肤上,应立即用酒精擦洗 | |
| C. | 其在水中的溶解度随温度的升高而增大,超过65℃可以与水以任意比互溶 | |
| D. | 碳酸氢钠溶液中滴入苯酚的水溶液后立即放出二氧化碳 |

 Ⅰ.Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为2Li++FeS+2e-═Li2S+Fe,则该电池的总反应式为2Li+FeS═Li2S+Fe.
Ⅰ.Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为2Li++FeS+2e-═Li2S+Fe,则该电池的总反应式为2Li+FeS═Li2S+Fe.