题目内容
4.下列说法正确的是( )| A. | SiO2是酸性氧化物,能与溶液反应 | |
| B. | Na2CO3和NaHCO3都是盐,都能与CaCl2溶液反应 | |
| C. | CO和NO都是大气污染物,在空气中都能稳定存在 | |
| D. | Al在浓盐酸中会“钝化”,能用铝槽盛放浓盐酸 |
分析 A.二氧化硅能够与氢氧化钠溶液反应;
B.依据复分解反应的条件解答;
C.一氧化氮不稳定容易与空气中氧气反应生成二氧化氮;
D.浓盐酸不具有强的氧化性.
解答 解:A.二氧化硅能够与氢氧化钠溶液反应生成硅酸钠和水,故A正确;
B.碳酸钠与氯化钙反应生成沉淀符合复分解反应条件,碳酸氢钠与氯化钙符合复分解反应条件,不能发生反应,故B错误;
C.CO和NO都是大气污染物,CO在空气中能稳定存在,一氧化氮与氧气反应生成二氧化氮,故C错误;
D.浓盐酸不具有强的氧化性,铝与浓盐酸反应生成氯化铝和氢气,不能用铝罐盛放浓盐酸,故D错误;
故选:A.
点评 本题考查了元素化合物知识,熟悉二氧化硅、碳酸盐与碳酸氢盐、一氧化氮、浓盐酸的性质是解题关键,注意浓盐酸不具有强的氧化性,题目难度不大.

练习册系列答案
相关题目
14.已知甲醛(HCHO)分子中的4个原子是共平面的.下列分子中所有原子不可能同时存在于同一个平面上的是( )
| A. |  苯乙烯 苯乙烯 | B. | 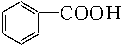 苯甲酸 苯甲酸 | C. | 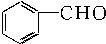 苯甲醛 苯甲醛 | D. |  苯乙酮 苯乙酮 |
12.(NH4)2SO4在一定条件下发生如下反应:4(NH4)2SO4$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+6NH3↑+3SO2↑+SO3↑+7H2O,将反应后的混合气体先通过置于冰水浴的U型管,再通入足量的BaCl2溶液,结果为( )
| A. | 产生BaSO4和BaSO3沉淀 | B. | 无沉淀产生 | ||
| C. | 产生BaSO4沉淀 | D. | 产生BaSO3沉淀 |
19.下表列出了前20号元素中的某些元素性质的有关数据:
试回答下列问题:
(1)以上10种元素的原子中,最容易失去电子的是②(填写编号);与H2最容易化合的非金属单质是氟气(写物质名称).
(2)写出元素⑤的氢化物结构式 ;③和⑤形成的化合物的电子式
;③和⑤形成的化合物的电子式 ;写出元素③和⑧形成的既有离子键,又有共价键的化合物的电子式
;写出元素③和⑧形成的既有离子键,又有共价键的化合物的电子式 ;
;
(3)某元素R的原子半径为1.02×10-10m,该元素在周期表中的位置第三周期第VIA族.
(4)写出上述⑥、⑦两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的一种物质的分子式PCl3.
(5)试比较⑤和⑨两元素的最高价氧化物对应的水化物的酸性强弱(填化学式):HClO4>HNO3
(6)写出④的最高价氧化物分别跟⑦和⑧的最高价氧化物的水化物反应的离子方程式OH-+Al(OH)3=AlO2-+2H2O,Al(OH)3+3H+=Al3++3H2O.
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径 (10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | -- | +3 | +4 | +5 | +7 | +1 | +5 | -- |
| 最低价态 | -- | -- | -2 | -- | -4 | -3 | -1 | -- | -3 | -1 |
(1)以上10种元素的原子中,最容易失去电子的是②(填写编号);与H2最容易化合的非金属单质是氟气(写物质名称).
(2)写出元素⑤的氢化物结构式
 ;③和⑤形成的化合物的电子式
;③和⑤形成的化合物的电子式 ;写出元素③和⑧形成的既有离子键,又有共价键的化合物的电子式
;写出元素③和⑧形成的既有离子键,又有共价键的化合物的电子式 ;
;(3)某元素R的原子半径为1.02×10-10m,该元素在周期表中的位置第三周期第VIA族.
(4)写出上述⑥、⑦两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的一种物质的分子式PCl3.
(5)试比较⑤和⑨两元素的最高价氧化物对应的水化物的酸性强弱(填化学式):HClO4>HNO3
(6)写出④的最高价氧化物分别跟⑦和⑧的最高价氧化物的水化物反应的离子方程式OH-+Al(OH)3=AlO2-+2H2O,Al(OH)3+3H+=Al3++3H2O.
16.下列说法中正确的是( )
| A. | 球棍模型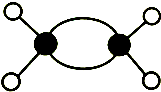 表示的有机物是乙烯 表示的有机物是乙烯 | |
| B. | 电子式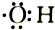 可以表示羟基,也可以表示氢氧根 可以表示羟基,也可以表示氢氧根 | |
| C. | 有机物 的分子式为C6H8O2 的分子式为C6H8O2 | |
| D. | 结构简式(CH3)2CHOH:可以表示1-丙醇,也可以表示2-丙醇 |
 名称:3,4-二甲基辛烷.
名称:3,4-二甲基辛烷. 已知A、B、C、D、E五种元素的原子序数依次增大,A元素位于周期表的s区,其原子中电子层数等于未成对电子数;B的基态原子中电子占据三种能量不同的原子轨道,且每种原子轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.E是有“生物金属”之称,E4+和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次增大,A元素位于周期表的s区,其原子中电子层数等于未成对电子数;B的基态原子中电子占据三种能量不同的原子轨道,且每种原子轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.E是有“生物金属”之称,E4+和氩原子的核外电子排布相同. .
.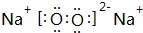 、
、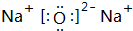 .
. .
.