题目内容
2.工业上用粗软锰矿(只含有MnO2和MnO)和H2SO4(过量)、FeS2制备MnSO4•H2O的流程如图所示(已知,流程中的FeS2、FeSO4、MnO2、MnO均完全反应)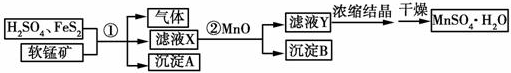
(1)①中发生了三个反应,其中两个反应是:MnO+H2SO4═MnSO4+H2O、FeS2+H2SO4═FeSO4+H2S↑+S↓
完成反应:1MnO2+2FeSO4+2H2SO4═1MnSO4+1Fe2(SO4)3+2H2O.
(2)沉淀A、B的化学式分别为S、Fe(OH)3,②中加入MnO的目的是调节pH,使Fe3+完全沉淀,则②中MnO参与反应的离子方程式:MnO+2H+═Mn2++H2O.
(3)若沉淀A的质量和MnSO4•H2O的质量分别为96.0g、321.1g,②中加入的MnO为0.1mol,则理论上粗软锰矿的MnO的质量分数为14.03%(精确到0.01%)
分析 粗软锰矿(只含有MnO2和MnO)和H2SO4(过量)、FeS2反应,二氧化锰和硫酸亚铁在酸性条件下反应,硫酸,提供酸性环境,各元素的化合价不变,MnO2中Mn元素的化合价降低,硫酸亚铁中铁元素化合价升高,发生反应,气体为H2S,沉淀A为S,滤液x为MnSO4、Fe2(SO4)3,②中加入MnO,Fe3+水解生成的H+与MnO反应,促进Fe3+水解并最终转化为沉淀,且不引入新的杂质,所以②中加入MnO的目的是调节pH,使Fe3+完全沉淀,沉淀B为Fe(OH)3,滤液Y为MnSO4,浓缩结晶得到MnSO4•H2O,
(1)Mn元素的化合价降低(+4→+2),MnO2是氧化剂,铁元素化合价升高(+2→+3),FeSO4为还原剂,根据得失电子守恒和元素守恒配平方程式;
(2)MnO2+2FeSO4+2H2SO4═MnSO4+Fe2(SO4)3+2H2O,气体为H2S,沉淀A为S,②中加入MnO的目的是调节pH,MnO与氢离子反应,促进Fe3+水解Fe3++3H2O?Fe(OH)3+3H+,并最终转化为Fe(OH)3沉淀;
(3)根据①中发生的三个反应,得出硫、铁、锰的关系式2S~2FeSO4~MnO2,n(MnO2)=$\frac{1}{2}$n(S),②中加入的MnO为0.1mol,结合已知质量进行解答.
解答 解:粗软锰矿(只含有MnO2和MnO)和H2SO4(过量)、FeS2反应,MnO+H2SO4═MnSO4+H2O、FeS2+H2SO4═FeSO4+H2S↑+S↓,二氧化锰和硫酸亚铁在酸性条件下反应,硫酸,提供酸性环境,各元素的化合价不变,MnO2中Mn元素的化合价降低,硫酸亚铁中铁元素化合价升高,发生反应:MnO2+2FeSO4+2H2SO4═MnSO4+Fe2(SO4)3+2H2O,气体为H2S,沉淀A为S,滤液x为MnSO4、Fe2(SO4)3,②中加入MnO,Fe3+水解生成的H+与MnO反应,MnO+2H+═Mn2++H2O,促进Fe3+水解Fe3++3H2O?Fe(OH)3+3H+,并最终转化为沉淀,且不引入新的杂质,所以②中加入MnO的目的是调节pH,使Fe3+完全沉淀,沉淀B为Fe(OH)3,滤液Y为MnSO4,浓缩结晶得到MnSO4•H2O,
(1)根据题意,反应物中要加入硫酸,MnO2中Mn元素的化合价降低(+4→+2)得到2e-,MnO2是氧化剂,FeSO4中铁元素化合价升高(+2→+3)失去e-,FeSO4为还原剂,加入硫酸,H2SO4中各元素的化合价不变,提供酸性环境,所以最小公倍数为2,根据得失电子守恒和元素守恒,该反应为:MnO2+2FeSO4+2H2SO4═MnSO4+Fe2(SO4)3+2H2O,
故答案为:1;2;2H2SO4;1;1Fe2(SO4)3;2H2O;
(2)MnO+H2SO4═MnSO4+H2O、FeS2+H2SO4═FeSO4+H2S↑+S↓,MnO2+2FeSO4+2H2SO4═MnSO4+Fe2(SO4)3+2H2O,所以反应①产物气体为H2S,沉淀A为S,②中加入MnO,Fe3+水解生成的H+与MnO反应,MnO+2H+═Mn2++H2O,促进Fe3+水解Fe3++3H2O?Fe(OH)3+3H+,并最终转化为沉淀B为Fe(OH)3,且不引入新的杂质,
故答案为:S、Fe(OH)3;MnO+2H+═Mn2++H2O;
(3)FeS2+H2SO4═FeSO4+H2S↑+S↓,MnO2+2FeSO4+2H2SO4═MnSO4+Fe2(SO4)3+2H2O,可得:关系式,2S~2FeSO4~MnO2,n(MnO2)=$\frac{1}{2}$n(S)=$\frac{1}{2}×$$\frac{96g}{32g/mol}$=1.5 mol;321.1gMnSO4•H2O,n(MnSO4•H2O)=$\frac{321.1g}{169g/mol}$=1.9 mol,②中加入的MnO为0.1mol,根据锰元素守恒可知n(MnO)=1.9 mol-1.5 mol-0.1 mol=0.3 mol,则理论上粗软锰矿的MnO的质量分数为$\frac{0.3mol×71g/mol}{1.5mol×87g/mol+0.3mol×71g/mol}$×100%≈14.03%,
故答案为:14.03%.
点评 本题考查了氧化还原反应配平、化学计算、工艺流程等,意在考查考生的综合应用能力,(3)理顺2S~2FeSO4~MnO2,以及n(MnO2)=$\frac{1}{2}$n(S)为该题的难点,题目难度中等.

| A. | 甲醛是甲基跟醛基相连而构成的 | |
| B. | 饱和一元醛的通式可简写为RCOH | |
| C. | 在银镜反应中乙醛体现了氧化性 | |
| D. | 饱和一元脂肪醛的分子组成符合通式CnH2nO |
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 102 | 74 |
| 主要化合价 | +2 | +3 | +6、+4、-2 | -2 |
| A. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| B. | 气态氢化物的稳定性H2Z<H2W | |
| C. | X、Y元素的金属性X<Y | |
| D. | 一定条件下,Z单质与W的常见单质直接生成ZW3 |
| A. | 13C与15N具有相同的中子数 | B. | 13C与C60是同一种物质 | ||
| C. | 15N与14N互为同位素 | D. | 15N的核外电子数与中子数相同 |
 (1)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,其中O2的质量分数为27.6%.若其中CO和N2的物质的量之比为1:1,则混合气体中氧元素的质量分数为48.3%.
(1)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,其中O2的质量分数为27.6%.若其中CO和N2的物质的量之比为1:1,则混合气体中氧元素的质量分数为48.3%. ,晶体类型为分子晶体.
,晶体类型为分子晶体.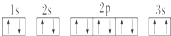 ,该同学所画的电子排布图违背了泡利原理.
,该同学所画的电子排布图违背了泡利原理.