题目内容
7.铁是目前人类使用量最大的金属,它能形成多种化合物.(1)取5.6g的生铁与足量的稀硫酸混合反应,无论怎样进行实验,最终收集了的气体体积均小于2.24L(标准状况),最主要的原因是生铁中含有碳等杂质,所得溶液在长时间放置过程中会慢慢出现浅黄色,试用离子方程式解释这一变化的原因4Fe2++O2+4H+=4Fe3++2H2O.
(2)ZnFe2Ox是一种新型纳米材料,可将工业废气中的某些元素转化为游离态,制取纳米ZnFe2Ox 和用于除去废气的转化关系如图ZnFe2O4$?_{CO_{2}、NO_{2}、SO_{2}/常温}^{H_{2}/高温}$ZnFe2Ox.若上述转化反应中消耗的n(ZnFe2O4):n(H2)=2:1,x的值为3.5.请写出 ZnFe2Ox与NO2 反应的化学方程式2NO2+8ZnFe2O3.5=N2+8ZnFe2O4(x用前一问求出的具体值).
(3)LiFePO4(难溶干水)材料被视为最有前途的锂离子电池材料之一.
①以 FePO4(难溶于水)、Li2CO3、单质碳为原料在高温下制备LiFePO4,该反应还生成一种可燃性气体,则反应方程式为2FePO4+Li2CO3+2C$\frac{\underline{\;高温\;}}{\;}$2LiFePO4+3CO↑.
②磷酸铁锂动力电池有几种类型,其中一种(中间是锂离子聚合物的隔膜,它把正极与负桩隔开)工作原理为FePO4+Li$?_{充电}^{放电}$ LiFePO4.则放电时正极上的电极反应式为FePO4+Li++e-=LiFePO4.
(4)已知25℃时Ksp[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配制5mol/L 100mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加人2.5mL 2mol/L的盐酸(忽略加入盐酸体积).
分析 (1)生铁中含有碳元素等物质,故5.6g铁物质的量少于0.1mol,与HCl反应生成的气体偏少.变黄色说明Fe2+被氧气氧化为Fe3+.
(2)当反应中n(ZnFe2O4):n(H2)=2:1时,依得失电子守恒原理可求出铁的价态为升高了0.5价,由此可求出x=3.5,根据元素守恒和电子守恒分析.
(3)①可燃性气体是CO,反应过程中铁元素由+3价降低到+2价,Li2CO3中的碳元素由+4价降低到+2价,结合元素守恒和电子守恒配平方程式;
②放电时正极上Fe元素得电子发生还原反应.
(4)若不出现浑浊现象,则c(Fe3+)×C3(OH-)≤Ksp[Fe(OH)3],代入有关数据后可求出c(OH-)≤2×10-13mol/L,c(H+)≥0.0025mol/L,故至少要加入2.5ml相应的盐酸.
解答 解:(1)生铁中含有碳元素等物质,故5.6g铁物质的量少于0.1mol,生成的氢气的体积少于2.24L(标准状况);变黄色说明有Fe3+生成,是由Fe2+被氧气氧化所导致的,其反应的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O;
故答案为:生铁中含有碳等杂质;4Fe2++O2+4H+=4Fe3++2H2O.
(2)当反应中n(ZnFe2O4):n(H2)=2:1时,依得失电子守恒原理可求出铁的价态为升高了0.5价,由此可求出x=3.5; ZnFe2O3.5与NO2 反应生成N2和ZnFe2O4,其反应方程式为:2NO2+8ZnFe2O3.5=N2+8ZnFe2O4;
故答案为:3.5;2NO2+8ZnFe2O3.5=N2+8ZnFe2O4;
(3)①可燃性气体是CO,反应过程中铁元素由+3价降低到+2价,Li2CO3中的碳元素由+4价降低到+2价,由此可写出对应的反应式:2FePO4+Li2CO3+2C$\frac{\underline{\;高温\;}}{\;}$2LiFePO4+3CO↑;
故答案为:2FePO4+Li2CO3+2C$\frac{\underline{\;高温\;}}{\;}$2LiFePO4+3CO↑;
②已知FePO4+Li$?_{充电}^{放电}$ LiFePO4,FePO4中Fe元素得电子,则放电时FePO4在正极发生得电子的发生还原反应,正极的方程式为:FePO4+Li++e-=LiFePO4;
故答案为:FePO4+Li++e-=LiFePO4;
(4)若不出现浑浊现象,则c(Fe3+)×C3(OH-)≤Ksp[Fe(OH)3],代入有关数据后可求出c(OH-)≤2×10-13mol/L,c(H+)≥0.0025mol/L,故至少要加入2.5mL相应的盐酸;
故答案为:2.5.
点评 本题考查了氧化还原反应、离子方程式的书写、化学方程式的书写、原电池原理的应用等,题目难度中等,侧重于基础知识的综合应用考查.

| A. | 2,2-二甲基-1-丁烯 | B. | 2,3-二甲基-2-乙基丁烷 | ||
| C. | 3,3,5,5-四甲基己烷 | D. | 2-甲基-1,3-丁二烯 |
| A. | b L | B. | (b-a)L | C. | (2a-b)L | D. | (2b-a)L |
①Ca(HCO3)2 ②Al(OH)3 ③NaAlO2 ④(NH4)2S ⑤Al.
| A. | ①② | B. | ②③⑤ | C. | ①②④⑤ | D. | 全部 |

| A. | 外接负载时,左槽作为原电池负极,发生氧化反应 | |
| B. | 外接电源时,左槽连接外接电源的正极,发生还原反应 | |
| C. | 负载是镀铜的电镀槽时,H+由左槽向右槽移动 | |
| D. | 充电时若转移电子数为3.01×1023个,左槽溶液中n(H+)的变化量为0.5mol |
 +
+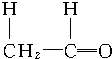 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$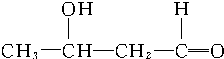
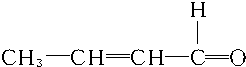 +2H2$→_{△}^{催化剂}$
+2H2$→_{△}^{催化剂}$