7.部分弱酸的电离平衡常数如下表:
下列选项正确的是( )
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | K=1.77×10-4 | K=4.9×10-10 | K1=4.3×10-7,K2=5.6×10-11 |
| A. | 在NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-) | |
| B. | 向NaCN溶液中通入少量CO2的离子方程式:2CN-+H2O+CO2=2HCN+CO32- | |
| C. | 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者 | |
| D. | 等物质的量浓度的各溶液pH关系为:pH(NaHCO3)>pH(NaCN)>pH(HCOONa) |
6.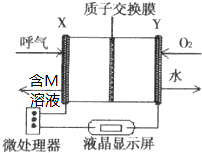 查处酒后驾驶所采用的“便携式乙醇测量仪”,以燃料电池为工作原理,如图,两电极材料均为Pt.理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为M,其中一个电极的反应式为:CH3CH2OH-2e-→M+2H+.下列说法中正确的是( )
查处酒后驾驶所采用的“便携式乙醇测量仪”,以燃料电池为工作原理,如图,两电极材料均为Pt.理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为M,其中一个电极的反应式为:CH3CH2OH-2e-→M+2H+.下列说法中正确的是( )
 查处酒后驾驶所采用的“便携式乙醇测量仪”,以燃料电池为工作原理,如图,两电极材料均为Pt.理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为M,其中一个电极的反应式为:CH3CH2OH-2e-→M+2H+.下列说法中正确的是( )
查处酒后驾驶所采用的“便携式乙醇测量仪”,以燃料电池为工作原理,如图,两电极材料均为Pt.理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为M,其中一个电极的反应式为:CH3CH2OH-2e-→M+2H+.下列说法中正确的是( )| A. | 电池内部H+向X极移动 | |
| B. | 另一极Y极的电极反应式为:O2+4e-+2H2O=4OH- | |
| C. | 乙醇在X极上发生还原反应,电子经过外电路流向Y极 | |
| D. | 电池总反应为:2CH3CH2OH+O2→2CH3CHO+2H2O |
5.下列实验一定能达到预期目的是( )
| 选项 | 实验内容 | 实验目的 |
| A | 在食盐水中通入氟气置换出氯气 | 证明氟的非金属性强于氯 |
| B | 将滴有酚酞试液的氨水分成两份,并加热其中一份溶液 | 研究温度对弱电解质电离的影响 |
| C | 分别用玻璃棒蘸c(H+)相同的乙二酸和乙酸溶液,点在pH试纸上,并与标准比色卡对比 | 比较乙二酸和乙酸的酸性强弱 |
| D | 室温下,分别向体积、浓度均相同的Na2S2O3溶液中加入相同体积、不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
2.晶体硼由105B和115B两种同位素原子构成.已知5.4g晶体硼全部转化成B2H6(硼烷)气体时,可得标准状况下5.6L硼烷,则下列说法正确的是( )
| A. | 晶体中105B和115B两种同位素原子的质量比为1:4 | |
| B. | 5.4 g该晶体硼所含中子为2.9 mol | |
| C. | 等质量的分别由105B和115B构成的晶体硼所含中子数之比为6:5 | |
| D. | 若碳原子质量为w g,则105B原子的质量为10w g |
1.已知有物质的量相等的短周期元素的单质X和Y,在X中加入足量盐酸,在Y中加入足量稀硫酸,反应完全后,生成氢气的体积分别为V1和V2(相同状况下测定),且V1≠V2,若要确定生成物中X和Y的化合价,至少还需要的数据是( )
| A. | V1:V2的值 | B. | V1和V2的值 | ||
| C. | X和Y的物质的量 | D. | 盐酸和稀硫酸的物质的量浓度 |
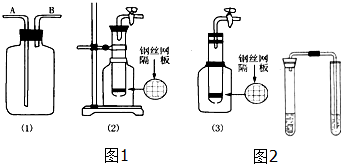
19.某化学探究小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质的成分.具体操作如下:向C装置中通入一定量的氯气后,测得只生成一种气体Cl2O.可以确定的是C得到的固体中最多含有三种物质,含有氯元素的盐只有一种,且一定含有NaHCO3.现对C中得到的固体进行猜想和验证.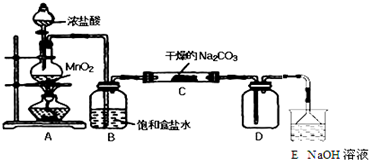
①提出合理猜想:C中一定含有NaHCO3和NaCl;可能含有剩余的Na2CO3.
②设计方案,进行成分检验.请你参与并完成实验步骤3、4以及预期现象和结论,将答案填入下表的相应空格内.限选实验试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、品红、稀盐酸

①提出合理猜想:C中一定含有NaHCO3和NaCl;可能含有剩余的Na2CO3.
②设计方案,进行成分检验.请你参与并完成实验步骤3、4以及预期现象和结论,将答案填入下表的相应空格内.限选实验试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、品红、稀盐酸
| 实 验 步 骤 | 预 期 现 象 和 结 论 |
| 步骤1:取C中的少量固体样品于试管中, 加入蒸馏水至固体溶解,然后各取1~2mL 所得溶液分别置于甲、乙两支试管中. | 得到无色溶液. |
| 步骤2:向甲试管中加入过量的BaCl2溶液, 静置. | 若溶液变浑浊,证明固体中含有Na2CO3. |
| 步骤3:取甲试管中上层清液少许于另一只 试管中,滴加少量澄清石灰水, 充分振荡. | 若上层清液变浑浊, 证明固体中含有NaHCO3. |
| 步骤4:向乙试管中先加入过量的稀HNO3 稀HNO3;再滴入少量AgNO3溶液溶液. | 若生成白色沉淀;证明固体中含有氯化钠. |
18.以下有关实验操作的叙述不正确的是( )
0 167395 167403 167409 167413 167419 167421 167425 167431 167433 167439 167445 167449 167451 167455 167461 167463 167469 167473 167475 167479 167481 167485 167487 167489 167490 167491 167493 167494 167495 167497 167499 167503 167505 167509 167511 167515 167521 167523 167529 167533 167535 167539 167545 167551 167553 167559 167563 167565 167571 167575 167581 167589 203614
| A. | 利用分液漏斗进行分液操作时,先打开分液漏斗旋塞,使下层液体慢慢流出,待下层液体完全流出后,关闭旋塞,再将上层液体从上口倒出 | |
| B. | 用镊子夹取金属钠固体,切割取用后剩余的钠放回原试剂瓶中 | |
| C. | 用标准浓度的盐酸滴定未知浓度NaOH溶液时,酸式滴定管用蒸馏水洗净后未用同浓度盐酸润洗,将导致测定结果偏低 | |
| D. | 溶液配制、中和滴定实验中,容量瓶、锥形瓶用蒸馏水洗净后即可使用;而滴定管、移液管用蒸馏水洗净后,须再用待装液润洗2~3次后方可使用 |
 .
. .常温下,D2E2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中正确的是ACD.
.常温下,D2E2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中正确的是ACD.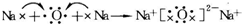 .
.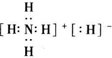 ,其中所含的化学键类型有离子键、共价键(填“离子键”、“共价键”),此化合物与足量水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.
,其中所含的化学键类型有离子键、共价键(填“离子键”、“共价键”),此化合物与足量水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.