题目内容
3.原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.(1)X元素是H(填元素符号).
(2)X与W组成的化合物中存在共价键(填“离子键”或“共价键”).
(3)由X、Y两种元素可组一种化学式为YX5的固体化合物,此固体化合物的电子式为
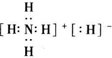 ,其中所含的化学键类型有离子键、共价键(填“离子键”、“共价键”),此化合物与足量水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.
,其中所含的化学键类型有离子键、共价键(填“离子键”、“共价键”),此化合物与足量水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.(4)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,发生该反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(5)由X、Y、Z、W四种元素组成的一种离子化合物A.
①已知1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体.写出加热条件下A与NaOH溶液反应的离子方程式NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$H2O+NH3↑.
②又知A既能与盐酸反应,又能与氯水反应,写出A与氯水反应的离子方程式:SO32-+Cl2+H2O=SO42-+2Cl-+2H+.
(6)由X、Y、Z、W和铁五种元素组成的式量为392的化合物B,1mol B中含有6mol结晶水.对化合物B进行如下实验:
I.取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色有刺激性气味气体.生成的白色沉淀迅速变为灰绿色,最终变为红褐色.
II.取适量B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解.
①已知100mL 1mol/L B的溶液能与20mL 1mol/L KMnO4溶液(硫酸酸化)恰好反应.写出反应的离子方程式5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O.
②综合上述可知B的化学式为(NH4)2SO4•FeSO4•6H2O.
分析 原子序数由小到大排列的四种短周期元素X、Y、Z、W,在周期表中X是原子半径最小的元素,则X为H元素;Z、W位于同主族,设Z的原子序数为x,则W的原子序数为x+8,Y、Z左右相邻,Y的原子序数为x-1,由四种元素的原子序数之和为32,则1+(x-1)+x+(x+8)=32,解得x=8,即Y为N元素,Z为O元素,W为S元素.
(2)X与W组成的化合物为H2S,硫原子与H原子之间形成极性键;
(3)由H、N两种元素可组一种化学式为NH5的固体化合物,该化合物为NH4H,由铵根离子与氢负离子构成,含有离子键、共价键,足量水反应反应生成NH3•H2O与H2;
(4)由H、N、O、S四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,该酸为硝酸,反应生成硝酸铜、NO与水;
(5)由H、N、O、S四种元素组成的一种离子化合物A:
①1molA能与足量NaOH浓溶液反应生成标准状况下44.8L气体,说明该物质阳离子为NH4+,且1molA中含有2molNH4+,则A为硫酸铵或亚硫酸铵,铵根离子与氢氧根离子反应生成氨气;
②A既能与盐酸反应,又能与氯水反应,故A为亚硫酸铵,亚硫酸铵与足量的盐酸反应生成氯化铵、二氧化硫与水;
(6)由H、N、O、S和Fe五种元素组成的式量为392的化合物B,由B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体.过一段时间白色沉淀变为灰绿色,最终变为红褐色可知B中含有Fe2+、NH4+,另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解,则B中含有硫酸根离子,又1mol B中含有6mol结晶水,令B的化学式为x(NH4)2SO4•yFeSO4•6H2O,结合其相对分子质量确定化学式.Fe2+被氧化为Fe3+,根据电子转移守恒计算Mn元素在还原产物中化合价,确定还原产物,配平书写离子方程式.
解答 解:原子序数由小到大排列的四种短周期元素X、Y、Z、W,在周期表中X是原子半径最小的元素,则X为H元素;Z、W位于同主族,设Z的原子序数为x,则W的原子序数为x+8,Y、Z左右相邻,Y的原子序数为x-1,由四种元素的原子序数之和为32,则1+(x-1)+x+(x+8)=32,解得x=8,即Y为N元素,Z为O元素,W为S元素.
(1)由上述分析可知,X是H元素,故答案为:H;
(2)X与W组成的化合物为H2S,硫原子与H原子之间形成极性键共价键,故答案为:共价键;
(3)由H、N两种元素可组一种化学式为NH5的固体化合物,该化合物为NH4H,由铵根离子与氢负离子构成,电子式为: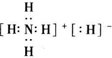 ,含有离子键、共价键,此化合物与足量水反应的化学方程式为:NH4H+H2O=NH3•H2O+H2↑,
,含有离子键、共价键,此化合物与足量水反应的化学方程式为:NH4H+H2O=NH3•H2O+H2↑,
故答案为: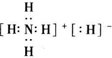 ;离子键、共价键;NH4H+H2O=NH3•H2O+H2↑;
;离子键、共价键;NH4H+H2O=NH3•H2O+H2↑;
(4)由H、N、O、S四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,该酸为硝酸,反应生成硝酸铜、NO与水,该反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(5)①由H、N、O、S组成的离子化合物A,1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体,即生成氨气为$\frac{44.8L}{22.4L/mol}$=2mol,说明1 molA中含有2molNH4+,则A为硫酸铵或亚硫酸铵,铵根离子与氢氧根离子反应方程式为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$H2O+NH3↑,
故答案为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$H2O+NH3↑;
②A既能与盐酸反应,又能与氯水反应,则A为(NH4)2SO3,与氯气反应的离子方程式为:SO32-+Cl2+H2O=SO42-+2Cl-+2H+,
故答案为:SO32-+Cl2+H2O=SO42-+2Cl-+2H+;
(6)①由H、N、O、S和Fe五种元素组成的式量为392的化合物B,由B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体.过一段时间白色沉淀变为灰绿色,最终变为红褐色,可知B中含有Fe2+、NH4+,另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解,则B中含有硫酸根离子,又1mol B中含有6mol结晶水,令B的化学式为x(NH4)2SO4•yFeSO4•6H2O,则:(96+36)x+(96+56)y+108=392,则x=y=1,故B的化学式为:(NH4)2SO4•FeSO4•6H2O,
B的物质的量为0.1L×1mol/L=0.1 mol,溶液中Fe2+为0.1mol,被氧化为Fe3+,高锰酸根离子的物质的量为0.02L×1mol/L=0.02 mol,设Mn元素在还原产物中化合价为a,根据电子转移守恒,0.1mol×(3-2)=0.02mol×(7-a),解得a=2,即含有生成Mn2+,故离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,
故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
②根据①中的分析可知,该物质的化学式为:(NH4)2SO4•FeSO4•6H2O,故答案为:(NH4)2SO4•FeSO4•6H2O.
点评 本题考查位置结构性质的应用、无机物推断等,明确Y、Z、W的位置及原子序数的关系来推断元素是关键,需要学生熟练掌握元素化合物性质,难度中等.

| A. |  苯乙烯 苯乙烯 | B. |  苯甲酸 苯甲酸 | C. | 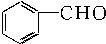 苯甲醛 苯甲醛 | D. |  苯乙酮 苯乙酮 |
| A. | 利用分液漏斗进行分液操作时,先打开分液漏斗旋塞,使下层液体慢慢流出,待下层液体完全流出后,关闭旋塞,再将上层液体从上口倒出 | |
| B. | 用镊子夹取金属钠固体,切割取用后剩余的钠放回原试剂瓶中 | |
| C. | 用标准浓度的盐酸滴定未知浓度NaOH溶液时,酸式滴定管用蒸馏水洗净后未用同浓度盐酸润洗,将导致测定结果偏低 | |
| D. | 溶液配制、中和滴定实验中,容量瓶、锥形瓶用蒸馏水洗净后即可使用;而滴定管、移液管用蒸馏水洗净后,须再用待装液润洗2~3次后方可使用 |
| A. | NaNO2发生氧化反应 | |
| B. | NH4Cl 中的氮元素被还原 | |
| C. | N2既是氧化产物,又是还原产物 | |
| D. | 每生成1mol N2转移电子的物质的量为6mol |
| A. | 产生BaSO4和BaSO3沉淀 | B. | 无沉淀产生 | ||
| C. | 产生BaSO4沉淀 | D. | 产生BaSO3沉淀 |
 名称:3,4-二甲基辛烷.
名称:3,4-二甲基辛烷.