题目内容
18.以下有关实验操作的叙述不正确的是( )| A. | 利用分液漏斗进行分液操作时,先打开分液漏斗旋塞,使下层液体慢慢流出,待下层液体完全流出后,关闭旋塞,再将上层液体从上口倒出 | |
| B. | 用镊子夹取金属钠固体,切割取用后剩余的钠放回原试剂瓶中 | |
| C. | 用标准浓度的盐酸滴定未知浓度NaOH溶液时,酸式滴定管用蒸馏水洗净后未用同浓度盐酸润洗,将导致测定结果偏低 | |
| D. | 溶液配制、中和滴定实验中,容量瓶、锥形瓶用蒸馏水洗净后即可使用;而滴定管、移液管用蒸馏水洗净后,须再用待装液润洗2~3次后方可使用 |
分析 A.分液时,先从下口放出下层液体,再从上口倒出上层液体;
B.钠易与空气中氧气和水反应,应保存在煤油中;
C.根据c(待测)=$\frac{c(标准)×c(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
D.容量瓶中允许有少量水存在,锥形瓶不能润洗,滴定管和移液管里使用时需要润洗.
解答 解:A.分液时,避免上下层液体混合,先打开分液漏斗旋塞,使下层液体慢慢流出,待下层液体完全流出后,关闭旋塞,上层液体再从上面倒出,操作合理,故A正确;
B.做金属钠的性质实验时,剩余的钠放回原试剂瓶,由于钠很活泼,且如果将钠随意丢弃容易引起火灾、爆炸等事故,故B正确;
C.酸式滴定管用蒸馏水洗后未用标准液润洗就装标准液滴定,标准液浓度偏小,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×c(标准)}{V(待测)}$可知c(待测)偏大,故C错误;
D.容量瓶中允许有少量水存在,锥形瓶不能润洗,滴定管和移液管使用前必需润洗,否则容器内若有水,就把溶液稀释了,故D正确,
故选:C.
点评 本题考查了物理变化和化学变化的区别,几种有机物的结构、性质,实验仪器的应用,难度不大,注意综合掌握.

练习册系列答案
相关题目
8.一定条件下,某密闭容器中充入等物质的量的A、B两种气体,发生反应:A(g)+B(g)═2C(g).达到平衡后,只改变反应的一个条件,测得容器中各物质的浓度、反应速率随时间变化如图所示.下列说法中正确的是( )
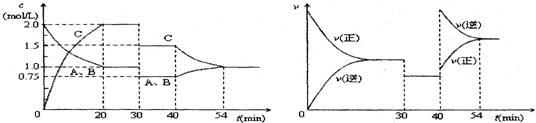

| A. | 30min时减小容积 | |
| B. | 40min时加入催化剂 | |
| C. | 0~20min内A的平均反应速率为0.05mol•L-1•min-1 | |
| D. | 正反应为吸热反应 |
10.去年下半年我省雾霾天气十分严重.PM2.5细颗粒物含有的毒性物质来源之一是汽车尾气排放.通过排气管加装催化装置,可有效减少CO和NO的排放,催化装置内发生的反应为:NOx+CO$\stackrel{催化剂}{→}$N2+CO2,下列关于此反应的说法中,不正确的是( )
| A. | 所涉及元素的第一电离能:N>O>C | |
| B. | 当x=2时,每生成1molN2,转移电子数为4mol | |
| C. | 等物质的量N2和C02中,π键的个数比为1:1 | |
| D. | 氧化剂与还原剂的物质的量之比为1:1时,NOx中氮元素的化合价为+2价 |
 )涂在手术后的伤口上,数秒钟内可发生加聚反应而固化,是一种固化迅速的医用高分子缝合材料.这种化合物是由三种单体合成的.试回答:
)涂在手术后的伤口上,数秒钟内可发生加聚反应而固化,是一种固化迅速的医用高分子缝合材料.这种化合物是由三种单体合成的.试回答: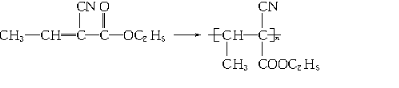 .
. 焰色反应是化学上用来测定某种金属是否存在于化合物的方法.
焰色反应是化学上用来测定某种金属是否存在于化合物的方法. ,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题:
,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题: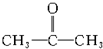 的官能团为
的官能团为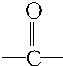 ,属于酮类物质,这两种物质的分子式为C3H6O,它们的关系是同分异构体.
,属于酮类物质,这两种物质的分子式为C3H6O,它们的关系是同分异构体.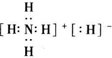 ,其中所含的化学键类型有离子键、共价键(填“离子键”、“共价键”),此化合物与足量水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.
,其中所含的化学键类型有离子键、共价键(填“离子键”、“共价键”),此化合物与足量水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑. 的系统命名为:2,4-二甲基-3-乙基己烷.
的系统命名为:2,4-二甲基-3-乙基己烷. <
< (填“>”“<”或“=”,下同)
(填“>”“<”或“=”,下同)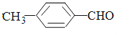 <
<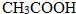 (提示:类比酚与醇的酸性)
(提示:类比酚与醇的酸性) ;
; )在催化剂条件下,合成聚乳酸(PLA)的反应方程式:
)在催化剂条件下,合成聚乳酸(PLA)的反应方程式: .
. 如图为实验室制氢气的简单装置.若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸又不够了,为使该反应顺利进行,则可以从长颈漏斗中加入的试剂是( )
如图为实验室制氢气的简单装置.若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸又不够了,为使该反应顺利进行,则可以从长颈漏斗中加入的试剂是( )