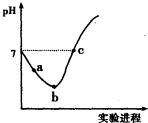
17.常温下,将Cl2缓慢通入水中至饱和,然后向其中滴加0.1mol•L-1NaOH溶液.整个实验过程中溶液的pH变化曲线如右图所示,不考虑次氯酸分解,下列叙述正确的是( )

| A. | 实验过程中用pH试纸测定溶液的pH | |
| B. | a~b段,溶液中$\frac{c({H}^{+})}{c(Cl{O}^{-})}$减小 | |
| C. | b点对应溶液中:c(Cl-)>c(H+)>c(HClO)>c(ClO-)>c(OH-) | |
| D. | c点对应溶液中:c(Na+)=2c(ClO-)+c(HClO) |
16.C60Si60是一种具有C60和Si60结构的新分子,即把“足球型”的C60置于“足球型”Si60内,Si原子与C原子以共价键结合,合成“二重构造”球形分子C60Si60的化学反应类似于( )
| A. | 乙烯制聚乙烯 | B. | 乙酸与乙醇制乙酸乙酯 | ||
| C. | 乙醇制乙醛 | D. | 苯酚与甲醛制酚醛树脂 |
15.我国京津冀地区部分城市常出现雾霾,其主要成分为细颗粒、SO2和NxOy、重金属离子及芳香烃等,对环境危害极大,对其治理越来越受到重视.下列说法正确的是( )
| A. | 重金属离子Ag+、Cu2+、K+均可导致蛋白质变性 | |
| B. | S02和NxOy都属于非金属氧化物,也都是酸性氧化物 | |
| C. | 部分颗粒分散在空气中可能会形成丁达尔现象 | |
| D. | 苯和苯的衍生物都是芳香烃 |
12.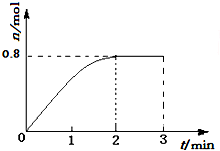 一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?C(g)+2D(s).2min末该反应达到平衡,生成D的物质的量如图.下列判断正确的是( )
一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?C(g)+2D(s).2min末该反应达到平衡,生成D的物质的量如图.下列判断正确的是( )
 一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?C(g)+2D(s).2min末该反应达到平衡,生成D的物质的量如图.下列判断正确的是( )
一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?C(g)+2D(s).2min末该反应达到平衡,生成D的物质的量如图.下列判断正确的是( )| A. | 若混合气体的密度不再改变时,该反应不一定达到平衡状态 | |
| B. | 2min后,加压会使正反应速率加快,逆反应速率变慢,平衡正向移动 | |
| C. | 反应过程中A和B的转化率之比为3:1 | |
| D. | 该条件下此反应的化学平衡常数的数值约为0.91 |
11.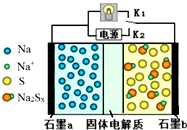 高温钠硫电池是一种新型可充电电池,其工作原理如图所示,图中固体电解质是Na+导体.下列叙述正确的是( )
高温钠硫电池是一种新型可充电电池,其工作原理如图所示,图中固体电解质是Na+导体.下列叙述正确的是( )
 高温钠硫电池是一种新型可充电电池,其工作原理如图所示,图中固体电解质是Na+导体.下列叙述正确的是( )
高温钠硫电池是一种新型可充电电池,其工作原理如图所示,图中固体电解质是Na+导体.下列叙述正确的是( )| A. | 放电时,石墨电极a为正极 | |
| B. | 放电时,Na+从石墨b向石墨a方向迁移 | |
| C. | 充电时,b极反应为Na2Sx-2e-=xS+2Na+ | |
| D. | 可将装置中的固体电解质改成NaCl溶液 |
10.铜有两种天然同位素,则${\;}_{29}^{63}$Cu+和${\;}_{29}^{65}$Cu具有相同的( )
| A. | 质量数 | B. | 中子数 | C. | 核电荷数 | D. | 能层和能级 |
9.现有六种元素,其中A、B、C、D为短周期主族元素,EF为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
(1)A的基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈哑铃形.
(2)E的基态原子核外电子排布式为1s22s22p63s23p63d54s1.
0 167343 167351 167357 167361 167367 167369 167373 167379 167381 167387 167393 167397 167399 167403 167409 167411 167417 167421 167423 167427 167429 167433 167435 167437 167438 167439 167441 167442 167443 167445 167447 167451 167453 167457 167459 167463 167469 167471 167477 167481 167483 167487 167493 167499 167501 167507 167511 167513 167519 167523 167529 167537 203614
| A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
| B元素原子的核外p电子总数比s电子总数少1 |
| C原子p轨道上成对电子数等于未成对电子数,且与A同周期 |
| D元素的主族序数与周期数的差为4,且不与A元素在同一周期 |
| E是第四周期中含未成对电子数最多的元素 |
| F基态原子外围电子排布式为(n+1)d3n(n+2)Sn |
(2)E的基态原子核外电子排布式为1s22s22p63s23p63d54s1.
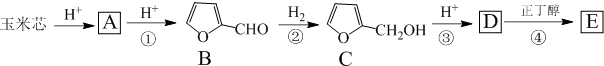
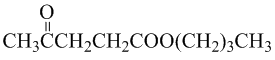 .
.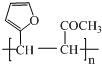 .写出反应的化学方程式
.写出反应的化学方程式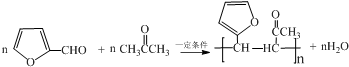 (不必注明反应条件).
(不必注明反应条件).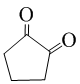 或
或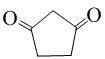 (任写一种).
(任写一种).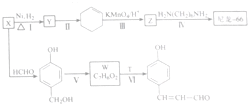

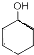 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O,反应类型为消去反应
+H2O,反应类型为消去反应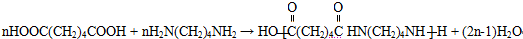 ,反应类型为缩聚反应
,反应类型为缩聚反应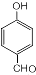 ,T的分子式为C2H4O
,T的分子式为C2H4O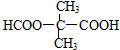 .
.