题目内容
11.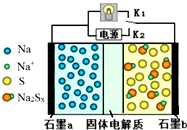 高温钠硫电池是一种新型可充电电池,其工作原理如图所示,图中固体电解质是Na+导体.下列叙述正确的是( )
高温钠硫电池是一种新型可充电电池,其工作原理如图所示,图中固体电解质是Na+导体.下列叙述正确的是( )| A. | 放电时,石墨电极a为正极 | |
| B. | 放电时,Na+从石墨b向石墨a方向迁移 | |
| C. | 充电时,b极反应为Na2Sx-2e-=xS+2Na+ | |
| D. | 可将装置中的固体电解质改成NaCl溶液 |
分析 A、根据图示信息知道:金属钠富集在石墨电极附近,据此确定高温钠硫电池的正负极材料;
B、原电池中,电解质中的阳离子移向正极;
C、充电时,在阳极上发生失电子的氧化反应,据此书写电极反应式;
D、金属钠可以和水之间发生反应,据此回答判断.
解答 解:A、根据图示信息知道:金属钠富集在石墨电极附近,据此确定石墨a是高温钠硫电池的负极材料,故A错误;
B、放电时属于原电池装置,电解质中的阳离子移向正极,即Na+从石墨a向石墨b方向迁移,故B错误;
C、充电时,在阳极上发生失电子的氧化反应,电极反应式为:Na2Sx-2e-=xS+2Na+,故C正确;
D、固体电解质不能改成NaCl溶液,因为钠单质会与水反应,故D错误.
故选C.
点评 本题考查学生原电池和电解池的工作原理知识,注意知识的归纳和梳理是关键,难度中等.

练习册系列答案
相关题目
2.下列说法不正确的是( )
| A. | 容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| B. | 在用简易量热计测定反应热时,可使用碎泡沫起隔热保温的作用、普通玻璃棒进行搅拌使酸和碱充分反应、准确读取实验时温度计最高温度、并且取2-3 次的实验平均值等措施,以达到良好的实验效果 | |
| C. | 金属着火时,可用细沙覆盖灭火;电器设备引起的火灾,不可用泡沫灭火器灭火 | |
| D. | 在4mL0.1mol•L-1的K2Cr2O7溶液中滴加数滴1mol•L-1的NaOH溶液,溶液颜色从橙色变成黄色 |
19.下列说法不正确的是( )
| A. | 激素类药物乙烯雌酚的结构简式为: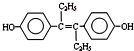 ,它的分子式是:C18H20O2 ,它的分子式是:C18H20O2 | |
| B. | 等质量的甲烷、乙烯、乙醇分别充分燃烧,所耗用氧气的量依次减少 | |
| C. | 聚乳酸(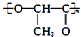 )是由单体之间通过加聚反应合成的 )是由单体之间通过加聚反应合成的 | |
| D. | 实验证实 可使溴的四氯化碳溶液褪色,说明该分子中存在碳碳双键. 可使溴的四氯化碳溶液褪色,说明该分子中存在碳碳双键. |
6.硫及其化合物用途广泛,许多金属硫化物难溶于水
(1)用硫酸厂的炉渣可制备聚铁[Fe2(OH)2(SO4)]n,聚铁中Fe元素的化合价是+2
(2)工业制Na2S的热化学方程式为:Na2SO4(s)+4C(s)=Na2S(n)+4CO(g)△H=+569.0kj/mol,生成过程中要加入过量的碳,同时还要通入空气,目的有两个,其一是使Na2SO4得到充分的还原(或提高Na2S的产量),其二是空气能够与过量的C反应放热,维持反应进行
(3)常温下工业用Na2SO4溶液吸收SO2尾气,现有吸收过程中,吸收液的pH随n(SO32-):n(HSO3-)的变化关系如表:
根据上表判断NaHSO3溶液显酸性,理由是HSO3-?H++SO32-,显酸性是因其电离大于其水解
(4)已知室温下,H2SO3的电离常数为K1:1.54×10-2 K2:1.024×10-7,H2CO3的电离常数为:K1=4.3×10-7K2=5.6×10-11,则下列微粒不能大量共存的是A(填答案选项的序号)
A.CO32-、HSO3- B.HCO3-、HSO3- C.SO32-、HSO3- D.SO32-、HCO3-
(5)已知:常温下,BaSO4的Ksp=1.1×10-22,向BaSO4悬浊液中加入硫酸,当溶液的pH=2时,溶液中c(Ba2+)=2.2×10-20mol/L
(6)过二硫酸钾(K2S2O4)常用作氧化剂,K2S2O4溶液与酸性MnSO4溶液混合,在催化剂作用下,可以观察到溶液变为紫色,该反应的离子方程式为5S2O82-+2Mn2++8H2O$\frac{\underline{\;催化剂\;}}{\;}$10SO42-+2MnO4-+16H+.
(1)用硫酸厂的炉渣可制备聚铁[Fe2(OH)2(SO4)]n,聚铁中Fe元素的化合价是+2
(2)工业制Na2S的热化学方程式为:Na2SO4(s)+4C(s)=Na2S(n)+4CO(g)△H=+569.0kj/mol,生成过程中要加入过量的碳,同时还要通入空气,目的有两个,其一是使Na2SO4得到充分的还原(或提高Na2S的产量),其二是空气能够与过量的C反应放热,维持反应进行
(3)常温下工业用Na2SO4溶液吸收SO2尾气,现有吸收过程中,吸收液的pH随n(SO32-):n(HSO3-)的变化关系如表:
| n(SO32-):n(HSO3-) | 91.9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
(4)已知室温下,H2SO3的电离常数为K1:1.54×10-2 K2:1.024×10-7,H2CO3的电离常数为:K1=4.3×10-7K2=5.6×10-11,则下列微粒不能大量共存的是A(填答案选项的序号)
A.CO32-、HSO3- B.HCO3-、HSO3- C.SO32-、HSO3- D.SO32-、HCO3-
(5)已知:常温下,BaSO4的Ksp=1.1×10-22,向BaSO4悬浊液中加入硫酸,当溶液的pH=2时,溶液中c(Ba2+)=2.2×10-20mol/L
(6)过二硫酸钾(K2S2O4)常用作氧化剂,K2S2O4溶液与酸性MnSO4溶液混合,在催化剂作用下,可以观察到溶液变为紫色,该反应的离子方程式为5S2O82-+2Mn2++8H2O$\frac{\underline{\;催化剂\;}}{\;}$10SO42-+2MnO4-+16H+.
16.C60Si60是一种具有C60和Si60结构的新分子,即把“足球型”的C60置于“足球型”Si60内,Si原子与C原子以共价键结合,合成“二重构造”球形分子C60Si60的化学反应类似于( )
| A. | 乙烯制聚乙烯 | B. | 乙酸与乙醇制乙酸乙酯 | ||
| C. | 乙醇制乙醛 | D. | 苯酚与甲醛制酚醛树脂 |
3.镁-次氯酸盐燃料电池,它具有比能量高、安全方便等优点.该电池的正极反应式为:ClO-+H2O+2e-=Cl-+2OH-,关于该电池的叙述正确的是( )
| A. | 该电池中镁为负极,发生还原反应 | |
| B. | 电池工作时,OH-向正极移动 | |
| C. | 该电池的总反应为:Mg+ClO-+H2O=Mg(OH)2↓+Cl- | |
| D. | 电池工作时,正极周围溶液的pH将不断变小 |
7.下列情况会对人体造成较大伤害的是( )
| A. | 用SO2漂白银耳 | |
| B. | 自来水中通入少量氯气消毒杀菌 | |
| C. | 用食醋清洗热水瓶胆内壁附着的水垢(水垢的主要成分为CaCO3、Mg(OH)2) | |
| D. | 用小苏打(NaHCO3)发酵面粉制作馒头 |
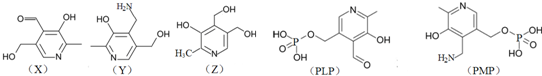
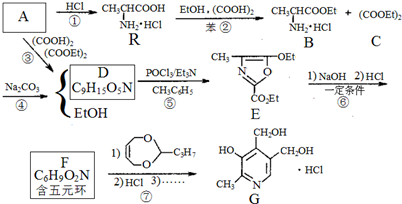
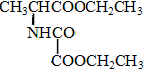 、F
、F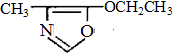 .
.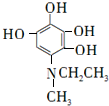 等.
等. .
.