题目内容
17.常温下,将Cl2缓慢通入水中至饱和,然后向其中滴加0.1mol•L-1NaOH溶液.整个实验过程中溶液的pH变化曲线如右图所示,不考虑次氯酸分解,下列叙述正确的是( )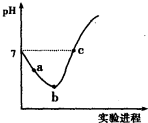
| A. | 实验过程中用pH试纸测定溶液的pH | |
| B. | a~b段,溶液中$\frac{c({H}^{+})}{c(Cl{O}^{-})}$减小 | |
| C. | b点对应溶液中:c(Cl-)>c(H+)>c(HClO)>c(ClO-)>c(OH-) | |
| D. | c点对应溶液中:c(Na+)=2c(ClO-)+c(HClO) |
分析 整个过程先后发生的反应为Cl2+H2O═HCl+HClO、HCl+NaOH═NaCl+H2O、HClO+NaOH═NaClO+H2O,
A.溶液中含有次氯酸,具有漂白性,不能用pH试纸测pH;
B.a~b段是氯气的溶解平衡:Cl2+H2O?H++Cl-+HClO向右进行的过程,酸性逐渐增强,氢离子浓度逐渐增大;
C.b点所示溶液中发生反应:Cl2+H2O=H++Cl-+HClO,HClO为弱电解质,部分电离,结合电荷守恒判断;
D.c点呈中性,则c(H+)=c(OH-),根据电荷守恒、物料守恒判断.
解答 解:A.溶液中含有次氯酸,具有漂白性,不能用pH试纸测pH,应选pH计,故A错误;
B.由a点到b点的过程是氯气的溶解平衡Cl2+H2O?H++Cl-+HClO向右进行的过程,酸性逐渐增强,氢离子浓度逐渐增大,溶液中$\frac{c({H}^{+})}{c(Cl{O}^{-})}$增大,故B错误;
C.b点所示溶液中发生反应:Cl2+H2O=H++Cl-+HClO,HClO为弱电解质,部分电离,溶液中存在的粒子有:H+、Cl-、ClO-、OH-,H2O、HClO、Cl2,溶液中:c(H+)>c(Cl-)>c(HClO)>c(ClO-)>c(OH-),故C错误;
D.c点溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(H+)+c(Na+)=c(Cl-)+c(Cl0-)+c(OH-),所以c(Na+)=c(Cl-)+c(ClO-),根据物料守恒得c(Cl-)=c(ClO-)+c(HClO),所以c(Na+)=c(HClO)+2c(ClO-),故D正确;
故选D.
点评 本题考查了离子浓度大小的判断,题目难度中等,明确溶液中的溶质及其性质是解本题关键,注意电荷守恒、物料守恒及盐的水解原理的应用方法.

| A. | 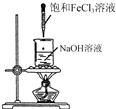 利用图所示操作制备氢氧化铁胶体 | |
| B. |  利用图所示装置制取NH3 | |
| C. | 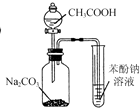 利用图所示装置证明H2CO3酸性强于苯酚 | |
| D. |  利用图所示装置制备乙酸乙酯 |
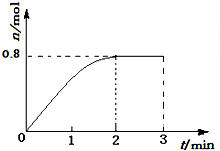 一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?C(g)+2D(s).2min末该反应达到平衡,生成D的物质的量如图.下列判断正确的是( )
一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?C(g)+2D(s).2min末该反应达到平衡,生成D的物质的量如图.下列判断正确的是( )| A. | 若混合气体的密度不再改变时,该反应不一定达到平衡状态 | |
| B. | 2min后,加压会使正反应速率加快,逆反应速率变慢,平衡正向移动 | |
| C. | 反应过程中A和B的转化率之比为3:1 | |
| D. | 该条件下此反应的化学平衡常数的数值约为0.91 |
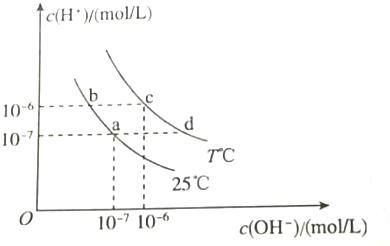
| A. | a点对应的溶液中:Al3+、Na+、Cl-、CO32- | |
| B. | b点对应的溶液中:K+、Ba2+、NO3-、AlO2- | |
| C. | c点对应的溶液中:Fe3+、Na+、I-、SO42- | |
| D. | d点对应的溶液中:Na+、K+、SO32-、Cl- |
| A. | BaSO3和BaSO4 | B. | BaS | C. | BaSO3 | D. | BaSO4 |
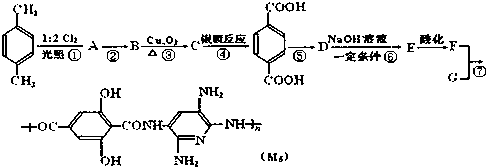
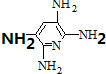 ,
, ;F的含氧官能团的名称有羧基、(酚)羟基.
;F的含氧官能团的名称有羧基、(酚)羟基.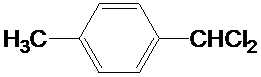 .
.
 .
.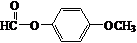 .
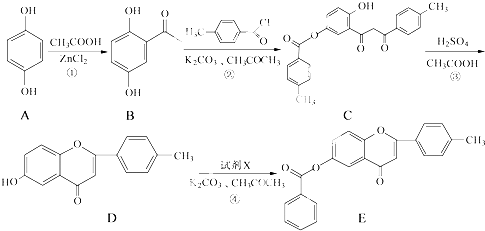
.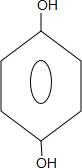 +CH3COOH$\stackrel{ZnCl_{2}}{→}$
+CH3COOH$\stackrel{ZnCl_{2}}{→}$ +H2O.
+H2O. .
.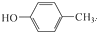 和CH3COOH为原料制备
和CH3COOH为原料制备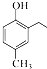 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选).合成路线流程图示例如下: