题目内容
9.现有六种元素,其中A、B、C、D为短周期主族元素,EF为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.| A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
| B元素原子的核外p电子总数比s电子总数少1 |
| C原子p轨道上成对电子数等于未成对电子数,且与A同周期 |
| D元素的主族序数与周期数的差为4,且不与A元素在同一周期 |
| E是第四周期中含未成对电子数最多的元素 |
| F基态原子外围电子排布式为(n+1)d3n(n+2)Sn |
(2)E的基态原子核外电子排布式为1s22s22p63s23p63d54s1.
分析 A、B、C、D为短周期主族元素,EF为第四周期元素,它们的原子序数依次增大,A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同,则A原子核外有6个电子,为C元素;
C原子p轨道上成对电子数等于未成对电子数,且与A同周期,则O元素;
B元素原子的核外p电子总数比s电子总数少1,且原子序数大于A而小于C,则B为N元素;
D元素的主族序数与周期数的差为4,且不与A元素在同一周期,则D位于第三周期,其主族序数为7,为Cl元素;
E是第四周期中含未成对电子数最多的元素,则E为Cr元素;
F基态原子外围电子排布式为(n+1)d3n(n+2)sn,s能级上最多排列2个电子,则F基态原子外围电子排布式为3d64s2,为Fe元素,再结合题目分析解答.
解答 解:A、B、C、D为短周期主族元素,EF为第四周期元素,它们的原子序数依次增大,A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同,则A原子核外有6个电子,为C元素;
C原子p轨道上成对电子数等于未成对电子数,且与A同周期,则O元素;
B元素原子的核外p电子总数比s电子总数少1,且原子序数大于A而小于C,则B为N元素;
D元素的主族序数与周期数的差为4,且不与A元素在同一周期,则D位于第三周期,其主族序数为7,为Cl元素;
E是第四周期中含未成对电子数最多的元素,则E为Cr元素;
F基态原子外围电子排布式为(n+1)d3n(n+2)sn,s能级上最多排列2个电子,则F基态原子外围电子排布式为3d64s2,为Fe元素,
(1)A为C元素,C原子的基态原子中能量最高的电子是2p电子,其电子云在空间有3个方向,原子轨道呈哑铃形,故答案为:3;哑铃;
(2)E是Cr元素,其原子核外有24个电子,根据构造原理知,Cr原子的基态原子核外电子排布式为1s22s22p63s23p63d54s1,故答案为:1s22s22p63s23p63d54s1.
点评 本题考查元素位置结构性质的相互关系及应用,熟悉原子结构、元素周期表结构是正确推断元素关键,知道前36号元素原子核外电子排布式的书写,注意Cr原子核外电子排布式中3d、4s能级电子都处于半满状态,题目难度不大.

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案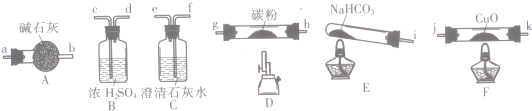
请回答:
(1)按气流方向,各装置从左到右的连接顺序为:i→cd→gh或hg→ab→jk或kj→fe尾气处理(填仪器接口的字母编号).
(2)说明CO能还原CuO的实验现象为F处硬质玻璃管中的黑色固体变为红色,C处澄清石灰水变浑浊.
(3)该实验处理尾气的方法为点燃烧掉或用气囊收集.
(4)若去掉B装置,可能产生的影响为NaHCO3分解产生的水蒸气高温能与碳粉反应生成H2,对实验产生干扰.
(5)将各装置按正确的顺序连接后进行实验.当反应结束后,F处硬质玻璃管中的固体全部变为红色.
[查阅资料]Cu和Cu2O均为红色;Cu2O在酸性溶液中能生成Cu和Cu2+.
[提出猜想]红色固体的成分可能为:①Cu;②Cu2O;③Cu和Cu2O.
[实验验证]该小组为验证上述猜想,分别取少量红色固体放人试管中,进行如下实验.
| 实验编号 | 操作 | 现象 |
| a | 加入足量稀硝酸、振荡 | 试管内红色固体完全溶解,溶液变为蓝色,并有无色气体产生 |
| b | 加入足量稀硫酸、振荡 | 试管内有红色固体,溶液为无色 |
[实验结论]根据上述实验结果,可知红色固体的成分为Cu(填化学式).
| A. | 2014年11月10日APCE国宴采用的帝王彩瓷餐具和常见的水晶饰品都属于硅酸盐制品 | |
| B. | 20mL0.1mol•L-1NaOH分别与10mL 0.2mol•L-1 CH3COOH、20mL0.1mol•L-1 CH3COOH反应,前者放出的热量比后者少 | |
| C. | Na2SO4•10H2O$?_{冷却}^{受热}$Na2SO4+10H2O利用该反应可以实现太阳能和化学能的相互转换 | |
| D. | 浓硫酸具有不同于稀硫酸的强氧化性、吸水性和脱水性等,主要是由于稀硫酸和浓硫酸中存在的主要微粒不同引起的 |
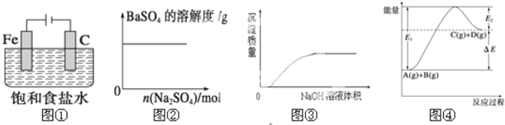
| A. | 图①表示防止铁腐蚀的装置图 | |
| B. | 图②表示向BaSO4饱和溶液中加入硫酸钠 | |
| C. | 图③表示将NaOH溶液滴入Ba(HCO3)3溶液中 | |
| D. | 图④表示反应物的总键能大于生成物的总键能 |
| A. | 棉、麻、羊毛、丝绸等天然衣着材料越来越受人们欢迎,它们的主要成分均为纤维素 | |
| B. | 晶体硅常用作太阳能电池板,它的工作原理符合电池原理 | |
| C. | 高炉炼铁、水泥工业、玻璃工业、海水制镁工业中都需要用到原料碳酸钙 | |
| D. | 雾霾中的PM2.5表面积大,分散在空气中形成胶体,吸附大量有毒有害物质,对人体造成严重危害 |
| A. | 臭氧层破坏--氟氯烃 | B. | 光化学烟雾--氮氧化物 | ||
| C. | 水体富营养化--含磷洗衣粉 | D. | 酸雨--二氧化碳 |