题目内容
12.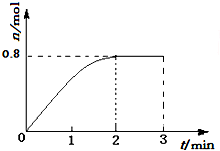 一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?C(g)+2D(s).2min末该反应达到平衡,生成D的物质的量如图.下列判断正确的是( )
一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?C(g)+2D(s).2min末该反应达到平衡,生成D的物质的量如图.下列判断正确的是( )| A. | 若混合气体的密度不再改变时,该反应不一定达到平衡状态 | |
| B. | 2min后,加压会使正反应速率加快,逆反应速率变慢,平衡正向移动 | |
| C. | 反应过程中A和B的转化率之比为3:1 | |
| D. | 该条件下此反应的化学平衡常数的数值约为0.91 |
分析 A、反应前后气体质量和气体体积发生变化,若混合气体的密度不再改变时,该反应一定达到平衡状态;
B、2min后,加压会使正、逆反应速率都加快,平衡正向移动;
C、将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,反应比和起始量之比相同,所以反应过程中A和B的转化率相同;
D、由图象中的数据,平衡后D生成物质的量为0.8mol,结合化学三段式列式
3A(g)+B(g)?C(g)+2D(s)
起始量(mol) 3 1 0 0
变化量(mol) 1.2 0.4 0.4 0.8
平衡量(mol) 1.8 0.6 0.4 0.8
平衡浓度为c(A)=0.9mol/L,c(B)=0.3mol/L,c(C)=0.2mol/L,D为固体不写入平衡常数计算式.
解答 解:A、反应生成固体D,气体质量和气体体积发生变化,若混合气体的密度不再改变时,该反应一定达到平衡状态,故A错误;
B、2min后,加压会使正、逆反应速率都加快,平衡正向移动,故B错误;
C、将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,反应比和起始量之比相同,所以反应过程中A和B的转化率之比为1:1,故C错误;
D、由图象中的数据,平衡后D生成物质的量为0.8mol,结合化学三段式列式
3A(g)+B(g)?C(g)+2D(s)
起始量(mol) 3 1 0 0
变化量(mol) 1.2 0.4 0.4 0.8
平衡量(mol) 1.8 0.6 0.4 0.8
平衡浓度为c(A)=0.9mol/L,c(B)=0.3mol/L,c(C)=0.2mol/L,D为固体
可计算得此反应的化学平衡常数=$\frac{0.2}{0.{9}^{3}×0.3}$=0.91,平衡常数约为0.91,故D正确.
故选:D.
点评 本题考查了化学平衡标志分析,平衡常数概念的计算应用,主要是一些反应速率、化学平衡的因素分析判断,掌握基础是关键,题目难度中等.

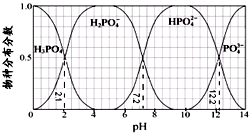
| A. | H3PO4的Ka3=10-12.2,HPO42-的水解平衡常数为10-6.8 | |
| B. | Na2HPO4 溶液显碱性,若向溶液中加入足量的CaCl2 溶液,溶液则显酸性 | |
| C. | 为获得尽可能纯的NaH2PO4,pH应控制在4~5.5左右 | |
| D. | pH=13时,溶液中各微粒浓度大小关系为:c(Na+)>c(HPO42-)>c(PO43-)>c(OH-)>c(H+) |
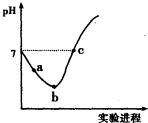
| A. | 实验过程中用pH试纸测定溶液的pH | |
| B. | a~b段,溶液中$\frac{c({H}^{+})}{c(Cl{O}^{-})}$减小 | |
| C. | b点对应溶液中:c(Cl-)>c(H+)>c(HClO)>c(ClO-)>c(OH-) | |
| D. | c点对应溶液中:c(Na+)=2c(ClO-)+c(HClO) |
| a | b | c | d | |
| A | Cu | CuSO4 | Cu(OH)2 | Cu2O |
| B | N2 | NO2 | HNO3 | NO |
| C | CH3OH | HCHO | HCOOH | HCOOCH3 |
| D | Na | Na2O2 | NaOH | NaCl |
| A. | A | B. | B | C. | C | D. | D |
| A. | 常温常压下28g氮气含有的原子数是2NA | |
| B. | 标准状况下,22.4L醋酸的水分子数是NA | |
| C. | 1molCl2与足量Fe反应,转移的电子数为2NA | |
| D. | 500mL 2mol•L-1Al(SO4)3溶液中SO42-的数目为3NA |
| A. | 可使石蕊试液褪色 | B. | 与足量的NaOH溶液反应生成Na2SO4 | ||
| C. | 不能与过氧化氢(H2O2)溶液反应 | D. | 能使品红褪色,加热后又出现红色 |
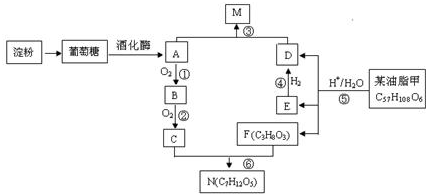
 ;C与F按不同的比例,还可以生成另外两种物质X、Y,且相对分子量X<N<Y,则Y的分子式C9H14O6.
;C与F按不同的比例,还可以生成另外两种物质X、Y,且相对分子量X<N<Y,则Y的分子式C9H14O6. C17H35COOCH2CH3+H2O.
C17H35COOCH2CH3+H2O.