10.下列指定粒子的个数比不为2:1的是( )
| A. | Be2+中的质子数和电子数比 | |
| B. | ${\;}_{1}^{3}$H原子中的中子数和电子数 | |
| C. | Na2CO3晶体中阳离子和阴离子个数比 | |
| D. | BaO2(过氧化钡)固体中阴离子和阳离子个数比 |
9.根据相似相溶规则和实际经验,下列叙述不正确的是( )
| A. | 白磷(P4)易溶于CS2,但难溶于水 | B. | NaCl易溶于水,难溶于CCl4 | ||
| C. | 碘易溶于苯,微溶于水 | D. | 卤化氢易溶于水,也易溶于CCl4 |
8.NH3分子的空间构型是三角锥形,而不是正三角形的平面结构,其充分的理由是( )
| A. | NH3分子是非极性分子 | |
| B. | 分子内3个N-H键的键长相等,键角相等 | |
| C. | NH3分子内3个N-H键的键长相等,3个键角都等于107°18′ | |
| D. | NH3分子内3个N-H键的键长相等,3个键角都等于120° |
7. 研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
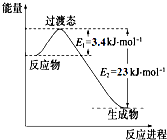
(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇蒸气和水蒸气.如图表示恒压容器中0.5molCO2和1.5molH2转化率达80%时的能量变化示意图.能判断该反应达到化学平衡状态的依据是bd.(填字母)
a.容器中压强不变 b.H2的体积分数不变
c.c(H2)=3c(CH3OH) d.容器中密度不变
e.2个C=O断裂的同时有6个H-H断裂.
(2)将不同量的CO(g)和H2O分别通入到体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①实验2条件下平衡常数K=$\frac{1}{6}$.
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b的值0<$\frac{a}{b}$<1(填具体值或取值范围).
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1 mol时,则此时v(正)<v(逆)(填“<”“>”或“=”).
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=-442.8kJ•mol-1.
(4)已知草酸是一种二元弱酸,草酸氢钠溶液显酸性.常温下,向10mL 0.01mol/L H2C2O4溶液中滴加10mL0.01mol/L NaOH溶液,比较溶液中各种离子浓度的大小关系c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
(5)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池,该电池的负极反应式为CH3OCH3-12e-+16OH-=2CO32-+11H2O.
 研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇蒸气和水蒸气.如图表示恒压容器中0.5molCO2和1.5molH2转化率达80%时的能量变化示意图.能判断该反应达到化学平衡状态的依据是bd.(填字母)
a.容器中压强不变 b.H2的体积分数不变
c.c(H2)=3c(CH3OH) d.容器中密度不变
e.2个C=O断裂的同时有6个H-H断裂.
(2)将不同量的CO(g)和H2O分别通入到体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度 ℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min[ | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b的值0<$\frac{a}{b}$<1(填具体值或取值范围).
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1 mol时,则此时v(正)<v(逆)(填“<”“>”或“=”).
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=-442.8kJ•mol-1.
(4)已知草酸是一种二元弱酸,草酸氢钠溶液显酸性.常温下,向10mL 0.01mol/L H2C2O4溶液中滴加10mL0.01mol/L NaOH溶液,比较溶液中各种离子浓度的大小关系c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
(5)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池,该电池的负极反应式为CH3OCH3-12e-+16OH-=2CO32-+11H2O.
5.关于下列图示装置运用的叙述正确的是( )
①装置甲可防止铁钉生锈
②装置乙可除去乙烷中混有的乙烯
③装置丙可验证HCl气体在水中的溶解性
④装置丁可除去乙酸乙酯中混有的乙酸
⑤装置戊可用于收集H2、CO2、Cl2、HCl、NO2等气体.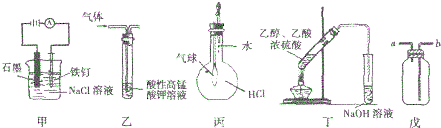
①装置甲可防止铁钉生锈
②装置乙可除去乙烷中混有的乙烯
③装置丙可验证HCl气体在水中的溶解性
④装置丁可除去乙酸乙酯中混有的乙酸
⑤装置戊可用于收集H2、CO2、Cl2、HCl、NO2等气体.

| A. | ③⑤ | B. | ③④ | C. | ①②④ | D. | ①③⑤ |
4.常温下,有0.1mol/L的①氯化铵、②氯化钠、③醋酸钠三种溶液.下列有关判断不正确的是( )
| A. | ①与②比较:c(Na+)>c(NH4+) | |
| B. | ①中的离子浓度的大小关系是:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | ①与②等体积混合的溶液中:c(Cl-)=c(NH4+)+c(Na+)+c(NH3•H2O) | |
| D. | 向③中加入适量醋酸溶液,使溶液pH=7,则:c(CH3COO-)>(Na+) |
2.某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.
实验一 配制并标定醋酸溶液的浓度取冰醋酸配制250mL 0.2mol•L-1的醋酸溶液,用0.2mol•L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定.
回答下列问题:
(1)配制250mL 0.2mol•L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和250mL容量瓶.
(2)为标定醋酸溶液的准确浓度,用0.2000mol.L-1的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
则该醋酸溶液的准确浓度为0.2000mol•L-1.(保留小数点后四位)
实验二 探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,结果如下:
回答下列问题:
(1)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是:0.0100mol•L-1醋酸的pH大于2或醋酸稀释10倍时,pH的变化值小于1.
(2)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度将增大(填“增大”减小”或“不变”)
实验一 配制并标定醋酸溶液的浓度取冰醋酸配制250mL 0.2mol•L-1的醋酸溶液,用0.2mol•L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定.
回答下列问题:
(1)配制250mL 0.2mol•L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和250mL容量瓶.
(2)为标定醋酸溶液的准确浓度,用0.2000mol.L-1的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
实验二 探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,结果如下:
| 醋酸浓度(mol•L-1) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
(1)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是:0.0100mol•L-1醋酸的pH大于2或醋酸稀释10倍时,pH的变化值小于1.
(2)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度将增大(填“增大”减小”或“不变”)
1.当Mg(OH)2在水中达到溶解平衡时“Mg(OH)2(s)?Mg2+(aq)+20H-(aq),要使Mg(OH)2进一步溶解,应向溶液中加少量的固体是( )
0 167241 167249 167255 167259 167265 167267 167271 167277 167279 167285 167291 167295 167297 167301 167307 167309 167315 167319 167321 167325 167327 167331 167333 167335 167336 167337 167339 167340 167341 167343 167345 167349 167351 167355 167357 167361 167367 167369 167375 167379 167381 167385 167391 167397 167399 167405 167409 167411 167417 167421 167427 167435 203614
| A. | NH4Cl | B. | NaOH | C. | Na2CO3 | D. | Fe |
 .
.
 .
.