题目内容
3.已知:NaHSO4在水中的电离方程式为NaHSO4=Na++H++SO42-(1)常温下,pH=5的NaHSO4溶液中水的电离程度=pH=9的NH3•H2O中水的电离程度.(填“>”、“=”或“<”)
(2)等体积等物质的量浓度的NaHSO4与氨水混合后,溶液呈酸性的原因为NH4++H2O?NH3•H2O+H+.(用离子方程式表示);若一定量的NaHSO4溶液与氨水混合后,溶液pH=7,则C(Na+)+C(NH4+)=2C(SO42-)(填“>”、“=”或“<”);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH>7(填“>”、“=”或“<”).
分析 (1)pH=5的NaHSO4溶液中,水的电离c(H+)=10-9mol/L,pH=9的NH3•H2O中水的电离c(H+)=10-9mol/L;
(2)等体积等物质的量浓度的NaHSO4与氨水混合后,反应生成硫酸钠、硫酸铵,铵根离子水解显酸性;PH=7,由电荷守恒分析离子浓度关系;用硫酸氢钠与氢氧化钡溶液制取硫酸钡,硫酸根离子完全沉淀,则二者以1:2反应,生成硫酸钡、NaOH.
解答 解:(1)pH=5的NaHSO4溶液中,水的电离c(H+)=10-9mol/L,pH=9的NH3•H2O中水的电离c(H+)=10-9mol/L,则两溶液中水的电离程度相等,
故答案为:=;
(2)等体积等物质的量浓度的NaHSO4与氨水混合后,反应生成硫酸钠、硫酸铵,铵根离子部分水解溶液显酸性,水解离子反应为:NH4++H2O?NH3•H2O+H+;
pH=7,氢离子与氢氧根离子浓度相等,由电荷守恒可知离子浓度关系为:c(Na+)+c(NH4+)=2c(SO42-);
用硫酸氢钠与氢氧化钡溶液制取硫酸钡,硫酸根离子完全沉淀,则二者以1:2反应,生成硫酸钡、NaOH,溶液显碱性,溶液的pH>7,
故答案为:NH4++H2O?NH3•H2O+H+;=;>.
点评 本题考查了溶液中的离子浓度大小比较,题目难度中等,试题涉及盐类水解、电离、离子之间的反应等知识点,综合性较强,充分考查了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
13.下列有关碱金属元素的叙述正确的是( )
| A. | 氢氧化铯碱性强于氢氧化钠 | |
| B. | 碱金属单质从Li到Cs,熔点依次升高 | |
| C. | 碱金属单质均为银白色,从Li到Cs,密度逐渐增大 | |
| D. | 碱金属元素形成的阳离子,从Li+到Cs+,氧化性依次增强 |
11.下列过程属于固氮的是( )
| A. | 分离液态空气制氮气 | B. | 闪电时氮气转化为一氧化氮 | ||
| C. | 氨气和硫酸反应制化肥 | D. | 氨气催化氧化制硝酸 |
8.NH3分子的空间构型是三角锥形,而不是正三角形的平面结构,其充分的理由是( )
| A. | NH3分子是非极性分子 | |
| B. | 分子内3个N-H键的键长相等,键角相等 | |
| C. | NH3分子内3个N-H键的键长相等,3个键角都等于107°18′ | |
| D. | NH3分子内3个N-H键的键长相等,3个键角都等于120° |
15.某元素的最高价氧化物的分子式RO2,其中含R27.27%.对此元素的叙述不正确的是( )
| A. | 该元素为碳 | B. | 该元素的气态氢化物含H 25% | ||
| C. | RO2为极性分子 | D. | RO2与水反应能生成酸 |
12.己烯雌酚是一种激素类药物,结构如下:
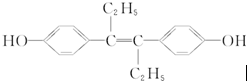
,下列有关叙述中不正确的是( )

,下列有关叙述中不正确的是( )
| A. | 它易溶于有机溶剂 | |
| B. | 可与NaOH和Na2CO3溶液发生反应 | |
| C. | 该有机物分子中一定有14个碳原子共平面 | |
| D. | 1 mol该有机物可与5 mol Br2发生反应 |
 或
或 或CH2=CHCH2OH.
或CH2=CHCH2OH.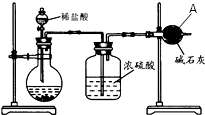 为测定碳酸钙的纯度(杂质SiO2),学生设计了如下几个实验方案,请回答每个方案中的问题.(相对原子质量:C=12 O=16 Ca=40)
为测定碳酸钙的纯度(杂质SiO2),学生设计了如下几个实验方案,请回答每个方案中的问题.(相对原子质量:C=12 O=16 Ca=40)