题目内容
4.常温下,有0.1mol/L的①氯化铵、②氯化钠、③醋酸钠三种溶液.下列有关判断不正确的是( )| A. | ①与②比较:c(Na+)>c(NH4+) | |
| B. | ①中的离子浓度的大小关系是:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | ①与②等体积混合的溶液中:c(Cl-)=c(NH4+)+c(Na+)+c(NH3•H2O) | |
| D. | 向③中加入适量醋酸溶液,使溶液pH=7,则:c(CH3COO-)>(Na+) |
分析 A.氯化铵溶液中,铵根离子部分水解,铵根离子浓度减小;
B.氯化铵溶液中,铵根离子水解,溶液显示酸性,c(Cl-)>c(NH4+)、c(H+)>c(OH-);
C.溶液中满足物料守恒,根据混合液中的物料守恒进行判断;
D.溶液的pH=7,溶液显示中性,则c(H+)=c(OH-),根据电荷守恒可知c(CH3COO -)=c(Na+).
解答 解:A.①氯化铵溶液中,铵根离子部分水解,则c(NH4+)<0.1mol/L,而②氯化钠溶液中,c(Na+)=0.1mol/l,则c(Na+)>c(NH4+),故A正确;
B.①氯化铵溶液中,铵根离子部分水解,则溶液中c(Cl-)>c(NH4+),溶液显示酸性,则c(H+)>c(OH-),溶液中离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故B正确;
C.①氯化铵、②氯化钠等体积混合后,体积增大1倍,则溶液中c(Cl-)=0.1mol/L,c(Na+)=0.05mol/L,c(NH4+)+c(NH3•H2O)=0.05mol/L,则c(Cl-)=c(Na+)+c(NH4+)+c(NH3•H2O),故C正确;
D.③中滴加适量醋酸溶液,使溶液pH=7,溶液显示中性,则c(H+)=c(OH-),根据电荷守恒c(CH3COO -)+c(OH-)=c(Na+)+c(H+)可知:c(CH3COO -)=c(Na+),故D错误;
故选D.
点评 本题考查了溶液中离子浓度大小比较,题目难度中等,注意掌握盐的水解原理,能够根据电荷守恒、物料守恒、盐的水解原理判断溶液中各离子浓度大小.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.下列有关卤族元素的叙述不正确的是( )
| A. | 卤素单质氧化性F2>Cl2>Br2>I2,因此排在前面的卤素单质均可将排在后面的卤素从它的盐溶液中置换出来 | |
| B. | 卤族元素从C1到I,最高价氧化物对应水化物的酸性减弱 | |
| C. | 卤族元素从F到I,HX水溶液酸性增强 | |
| D. | 卤素单质从F2到I2颜色加深,熔沸点升高 |
12.我国城市环境中的大气污染物主要是( )
| A. | CO2、Cl2、N2、酸雨 | B. | SO2、CO、NO2、烟尘 | C. | NH3、CO、NO2、雾 | D. | SO2、HCl、N2、粉尘 |
9.根据相似相溶规则和实际经验,下列叙述不正确的是( )
| A. | 白磷(P4)易溶于CS2,但难溶于水 | B. | NaCl易溶于水,难溶于CCl4 | ||
| C. | 碘易溶于苯,微溶于水 | D. | 卤化氢易溶于水,也易溶于CCl4 |
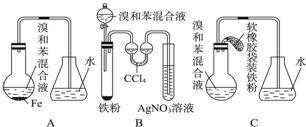
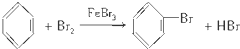 ,
,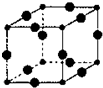 Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用.
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用.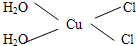 .
.