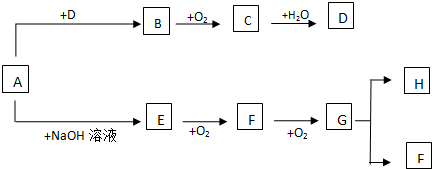
15.下列叙述中正确的是( )
| A. | 糖类不一定都是高分子化合物,但水解产物相同 | |
| B. | 甲苯能使酸性高锰酸钾溶液褪色,证明甲苯分子中存在单双键交替的结构 | |
| C. | 利用粮食酿酒经过了由淀粉→葡萄糖→乙醇的化学变化过程 | |
| D. | 甲醇、乙二醇(HOCH2CH2OH)互为同系物 |
14.下列条件下可能大量共存的离子组是( )
| A. | 某无色溶液中:NH4+、Na+、Cl-、MnO4- | |
| B. | 常温下由水电离出的c(H+)=1×10-13mol•L-1的溶液中:Na+、K+、SO32-、CO32- | |
| C. | 在c(H+)=1×10-13mol•L-1的溶液中:NH4+、Al3+、SO42-、NO3- | |
| D. | 在pH=1的溶液中:K+、Mg2+ SiO32- SO42- |
13.设NA为阿佛加德罗常数的数值,下列说法正确的是(相对原子质量:Na=23 Fe=56H=1 C=12 O=16 )( )
| A. | 1 mol Na2O2固体中含离子总数为3NA | |
| B. | 0.10 mol Fe粉与足量水蒸气反应生成的H2分子数为0.10NA | |
| C. | 40g NaOH溶于1L水中,所得NaOH 溶液的物质的量浓度为1mol/L | |
| D. | 标准状况下,11.2L苯中含有分子的数目为0.5NA |
12.碱性电池有容量大,放电电流大的特点,被广泛应用.锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn+2MnO2+H2O=Zn(OH)2+Mn2O3.下列说法错误的是( )
| A. | 电池工作时,锌失去电子 | |
| B. | 电池正极的电极反应式为2MnO2+H2O+2e-═Mn2O3+2OH- | |
| C. | 外电路中每通过0.2mol电子,锌的质量理论上减少13g | |
| D. | 电池工作时,电子由负极通过外电路流向正极 |
8.短周期主族元素A、B、C、D,原子序数依次增大.A、C原子序数相差8,A、B、C 三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半.下列叙述正确的是( )
| A. | 原子半径:A<D<C<B | |
| B. | 最简单氢化物的稳定性:D<C | |
| C. | A与C形成的化合物溶于水所得溶液显碱性 | |
| D. | B与D形成的化合物溶于水所得溶液显碱性 |
6.关于反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4,的说法中正确的是( )
0 167218 167226 167232 167236 167242 167244 167248 167254 167256 167262 167268 167272 167274 167278 167284 167286 167292 167296 167298 167302 167304 167308 167310 167312 167313 167314 167316 167317 167318 167320 167322 167326 167328 167332 167334 167338 167344 167346 167352 167356 167358 167362 167368 167374 167376 167382 167386 167388 167394 167398 167404 167412 203614
| A. | P既是氧化剂又是还原剂,CuSO4只是还原剂 | |
| B. | 若有11molP参加反应,转移电子的物质的量为60mol | |
| C. | 1molCuSO4可以氧化$\frac{1}{5}$molP | |
| D. | Cu3P既是氧化产物又是还原产物 |