题目内容
14.下列条件下可能大量共存的离子组是( )| A. | 某无色溶液中:NH4+、Na+、Cl-、MnO4- | |
| B. | 常温下由水电离出的c(H+)=1×10-13mol•L-1的溶液中:Na+、K+、SO32-、CO32- | |
| C. | 在c(H+)=1×10-13mol•L-1的溶液中:NH4+、Al3+、SO42-、NO3- | |
| D. | 在pH=1的溶液中:K+、Mg2+ SiO32- SO42- |
分析 A.MnO4-为紫色;
B.常温下由水电离出的c(H+)=1×10-13mol•L-1的溶液,为酸或碱溶液;
C.在c(H+)=1×10-13mol•L-1的溶液,显碱性;
D.pH=1的溶液,显酸性.
解答 解:A.MnO4-为紫色,与无色不符,故A不选;
B.常温下由水电离出的c(H+)=1×10-13mol•L-1的溶液,为酸或碱溶液,碱溶液中该组离子之间不反应,可大量共存,故B选;
C.在c(H+)=1×10-13mol•L-1的溶液,显碱性,碱性溶液中不能大量存在NH4+、Al3+,故C不选;
D.pH=1的溶液,显酸性,H+、SiO32-结合生成沉淀,不能大量共存,故D不选;
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,注意常见离子的颜色,题目难度不大.

练习册系列答案
相关题目
4.将一定量的氯气通入氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3的共存体系.下列判断不正确的是( )
| A. | 参加反应所需NaOH与氯气的物质的量之比一定为2:1 | |
| B. | 反应体系中n(NaCl):n(NaClO):n(NaC1O3)(物质的量之比)可能为11:1:2 | |
| C. | 若反应有amol氯气参加反应,则amol<转移电子数<$\frac{5a}{3}$mol | |
| D. | 反应中NaC1O和NaClO3为氧化产物,且物质的量之比一定为l:1 |
5.有机物甲、乙、丙(CH3COOC2H5)、丁 (CH3 CHO)与乙醇的转化关系如图所示.下列判断不正确的是( )


| A. | 甲是乙烯 | B. | 乙可能是葡萄糖 | ||
| C. | 丙与NaOH溶液反应不能生成乙醇 | D. | 丁十H2→乙醇的反应属于加成反应 |
2.在一定条件下,可逆反应2A(气)+B(气)?nC(固)+D(气)达平衡.若维持温度不变,增大压强,测得混合气体的平均相对分子质量不发生改变,则下列说法正确的是( )
| A. | 其他条件不变,增大压强,平衡不发生移动 | |
| B. | 其他条件不变,增大压强,混合气体的总质量不变 | |
| C. | 该反应式中n值一定为2 | |
| D. | 原混合气体中A与B的物质的量之比为2:1,且2M(A)+M(B)=3M(D)(其中M表示物质的摩尔质量) |
6.尿素是蛋白质代谢的产物,也是重要的化学肥料.工业合成尿素反应如下:
2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)
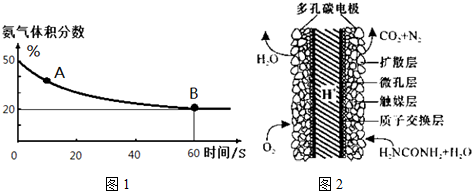
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图1所示.A点的正反应速率v正(CO2)>B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);
氨气的平衡转化率为75%.
(2)氨基甲酸铵是合成尿素的一种中间产物.将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)═NH2COONH4(s)
将实验测得的不同温度下的平衡数据列于下表:
①关于上述反应的焓变、熵变说法正确的是A.
A.△H<0,△S<0B.△H>0,△S<0 C.△H>0,△S>0D.△H<0,△S>0
②关于上述反应的平衡状态下列说法正确的是C
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
③氨基甲酸铵极易水解成碳酸铵,酸性条件水解更彻底.将氨基甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素.
此时溶液中c(NH4+)=0.1mol/L;
NH4+水解平衡常数值为4×10-9.
(3)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电.尿素燃料电池结构如图2所示,写出该电池的负极反应式:CO(NH2)2+H2O-6e-=CO2+N2+6H+.
2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)

(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图1所示.A点的正反应速率v正(CO2)>B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);
氨气的平衡转化率为75%.
(2)氨基甲酸铵是合成尿素的一种中间产物.将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)═NH2COONH4(s)
将实验测得的不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.△H<0,△S<0B.△H>0,△S<0 C.△H>0,△S>0D.△H<0,△S>0
②关于上述反应的平衡状态下列说法正确的是C
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
③氨基甲酸铵极易水解成碳酸铵,酸性条件水解更彻底.将氨基甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素.
此时溶液中c(NH4+)=0.1mol/L;
NH4+水解平衡常数值为4×10-9.
(3)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电.尿素燃料电池结构如图2所示,写出该电池的负极反应式:CO(NH2)2+H2O-6e-=CO2+N2+6H+.
3.下列关于有机物的说法中正确的是( )
| A. | 甲烷、苯、乙醇和乙酸在一定条件下都能发生取代反应 | |
| B. | 乙烯能使酸性高锰酸钾溶液和溴水褪色,二者反应原理相同 | |
| C. | 糖类、油脂和蛋白质都是高分子化合物,都能发生水解反应 | |
| D. | 蛋白质、人造纤维和光导纤维都属于有机高分子化合物 |
4.人工肾脏可用电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图,下列有关说法不正确的是( )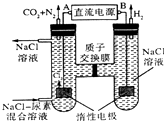

| A. | B为电源的正极 | |
| B. | 电解结束后,阴极室溶液的pH与电解前相比将升高 | |
| C. | 电子移动的方向是B→右侧惰性电极,左侧惰性电极→A | |
| D. | 阳极室中发生的反应依次为2Cl--2e-=Cl2↑、CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl |
 )主要存在于烟叶中,有浓郁的玉簪花香气,用于合成香料.现有如下转化关系,其中C能使溴的四氯化碳溶液褪色,E继续被氧化生成F,F的相对分子质量为90.
)主要存在于烟叶中,有浓郁的玉簪花香气,用于合成香料.现有如下转化关系,其中C能使溴的四氯化碳溶液褪色,E继续被氧化生成F,F的相对分子质量为90. $\stackrel{HCN}{→}$A$→_{H_{2}O}^{HCl}$B$→_{△}^{浓H_{2}SO_{4}}$C$→_{②Zn/H_{2}O}^{①O_{3}}$D+E
$\stackrel{HCN}{→}$A$→_{H_{2}O}^{HCl}$B$→_{△}^{浓H_{2}SO_{4}}$C$→_{②Zn/H_{2}O}^{①O_{3}}$D+E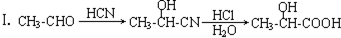
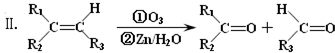
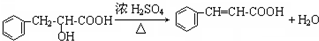 ;该反应类型属消去反应.
;该反应类型属消去反应.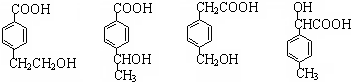 任意一种.
任意一种.