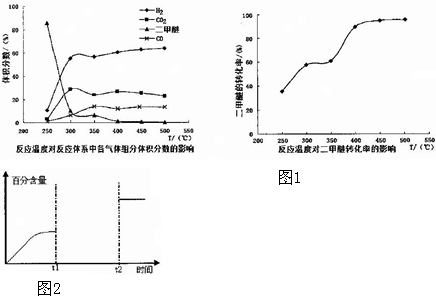
题目内容
6.关于反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4,的说法中正确的是( )| A. | P既是氧化剂又是还原剂,CuSO4只是还原剂 | |
| B. | 若有11molP参加反应,转移电子的物质的量为60mol | |
| C. | 1molCuSO4可以氧化$\frac{1}{5}$molP | |
| D. | Cu3P既是氧化产物又是还原产物 |
分析 11P+15CuSO4+24H2O═5Cu3P+6H3PO4+15H2SO4中,P元素的化合价由0降低为-3价,P元素的化合价由0升高为+5价,Cu元素的化合价由+2价降低为+1价,以此来解答.
解答 解:A.P、Cu元素的化合价降低,则P、CuSO4是氧化剂,P元素的化合价由0升高为+5价,P是还原剂,所以P既是氧化剂又是还原剂,CuSO4只是氧化剂,故A错误;
B.由原子守恒可知,11molP参加反应,被氧化的P为6mol,则转移的电子为6mol×5=30mol,故B错误;
C.由反应可知,转移30mol电子消耗11molP,15molCuSO4和5molP来一起氧化6molP,其中1mol CuSO4可以氧化$\frac{1}{5}$molP,故C正确;
D.P元素的化合价由0升高为+5价,P是还原剂,H3PO4是氧化产物,Cu3P是还原产物,故D错误;
故选C.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,注意从元素的化合价角度分析,题目难度不大.

练习册系列答案
相关题目
17.某有机物X的结构简式为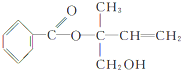 ,则下列有关说法正确的是( )
,则下列有关说法正确的是( )
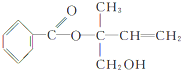 ,则下列有关说法正确的是( )
,则下列有关说法正确的是( )| A. | X的分子式为C12H16O3 | |
| B. | X在一定条件下能发生加成、加聚、取代、消去等反应 | |
| C. | 可用酸性高锰酸钾溶液区分苯和X | |
| D. | 在Ni作催化剂的条件下,1molX最多只能与1molH2加成 |
14.X、Y、Z、W是浓度均为0.01mol/L的溶液,其溶质分别是HCl、NH4Cl、NaOH、NaF中的某一种.室温下,溶液的pH如下表:下列说法正确的是( )
| 溶液 | X | Y | Z | W |
| pH | 12 | 2 | 7.7 | 5.6 |
| A. | 将Z溶液加水稀释至浓度为0.001mol/L,所得溶液pH=6.7 | |
| B. | 四种溶液中,水的电离程度最大的是W溶液 | |
| C. | 将X、W溶液按1:2的体积比混合,所得溶液中:c(H+)>c(OH-) | |
| D. | 将11mLX溶液与9mLY溶液混合(忽略混合时体积的变化),所得溶液pH=10 |
1.下列选项中,离子方程式书写正确的是( )
| A. | 向Fe(NO3)2和KI混合溶液中加入少量稀盐酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ | |
| B. | 泡沫灭火器的灭火原理:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ | |
| C. | 向硝酸银溶液中加入足量的氨水:Ag++2NH3•H2O=Ag(NH3)2++2H2O | |
| D. | 用足量的氨水处理硫酸工业的尾气:SO2+NH3•H2O=NH4++HSO3- |
18.用下列装置图进行相应的实验,其中正确的是( )
| A. | 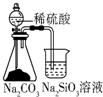 用如图可比较硫、碳、硅三种元素的非金属性强弱 | |
| B. | 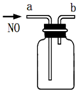 用如图装置收集一瓶纯净的NO | |
| C. |  用如图装置中U型管两端有液面差且保持不变时证明装置不漏气 | |
| D. | 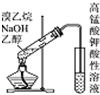 用如图检验溴乙烷与NaOH的醇溶液共热产生的乙烯 |
15.下列说法不正确的是( )
| A. | 常温下,在0.1mol•L-1的HNO3溶液中,由水电离出的c(H+)<$\sqrt{{K}_{W}}$ | |
| B. | 浓度为0.1mol•L-1的NaHCO3溶液:c(H2CO3)>c(CO32-) | |
| C. | 25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同 | |
| D. | 冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小 |