题目内容
8.短周期主族元素A、B、C、D,原子序数依次增大.A、C原子序数相差8,A、B、C 三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半.下列叙述正确的是( )| A. | 原子半径:A<D<C<B | |
| B. | 最简单氢化物的稳定性:D<C | |
| C. | A与C形成的化合物溶于水所得溶液显碱性 | |
| D. | B与D形成的化合物溶于水所得溶液显碱性 |
分析 短周期主族元素A、B、C、D原子序数依次增大,B原子最外层电子数等于A原子最外层电子数的一半,则A原子最外层电子数为偶数,A、C的原子序数的差为8,则A、C为同主族元素,A、B、C三种元素原子的最外层电子数之和为15,令B原子最外层电子数为x,则x+2x+2x=15,解的x=3,故A、C的最外层电子数为6,A为O元素,C为S元素,B的原子序数大于氧元素,最外层电子数为3,故B为Al元素,D的原子序数最大,故D为Cl元素,以此解答该题.
解答 解:短周期主族元素A、B、C、D原子序数依次增大,B原子最外层电子数等于A原子最外层电子数的一半,则A原子最外层电子数为偶数,A、C的原子序数的差为8,则A、C为同主族元素,A、B、C三种元素原子的最外层电子数之和为15,令B原子最外层电子数为x,则x+2x+2x=15,解的x=3,故A、C的最外层电子数为6,A为O元素,C为S元素,B的原子序数大于氧元素,最外层电子数为3,故B为Al元素,D的原子序数最大,故D为Cl元素,
A.同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径Al>S>Cl>O,即A<D<C<B,故A正确;
B.同周期自左而右非极性增强,非金属性Cl>S,非金属性越强,氢化物越稳定,故稳定性HCl>H2S,故B错误;
C.A为O元素,C为S元素,形成的化合物为二氧化硫或三氧化硫,溶液呈酸性,故C错误;
D.B为Al元素,D为Cl元素,形成的化合物为氯化铝,水解呈酸性,故D错误.
故选A.
点评 本题考查结构位置性质关系,难度中等,注意利用奇偶性及A、C的原子序数相差8判断二者处于同一主族(短周期),是推断元素关键.

练习册系列答案
相关题目
18.化学与生活、社会可持续发展密切相关.下列有关叙述不正确的是( )
| A. | 发生铅中毒时,可喝大量的牛奶或鸡蛋清来缓解病情 | |
| B. | CO2的水溶液呈酸性,CO2的大量排放会导致酸雨的形成 | |
| C. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 | |
| D. | 利用二氧化碳等原料合成聚碳酸酯类可降解塑料,有利于减少白色污染 |
19. 如图为向25mL0.1•L-1 NaOH溶液中逐滴滴加0.2mol•L-1 CH3COOH溶液过程中溶液pH的变化曲线.AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是( )
如图为向25mL0.1•L-1 NaOH溶液中逐滴滴加0.2mol•L-1 CH3COOH溶液过程中溶液pH的变化曲线.AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是( )
 如图为向25mL0.1•L-1 NaOH溶液中逐滴滴加0.2mol•L-1 CH3COOH溶液过程中溶液pH的变化曲线.AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是( )
如图为向25mL0.1•L-1 NaOH溶液中逐滴滴加0.2mol•L-1 CH3COOH溶液过程中溶液pH的变化曲线.AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是( )| A. | c(OH-)大于、小于或等于c(CH3COO-) | B. | c(OH-)一定等于c(CH3COO-) | ||
| C. | c(OH-)一定小于c(CH3COO-) | D. | c(OH-)一定大于c(CH3COO-) |
13.设NA为阿佛加德罗常数的数值,下列说法正确的是(相对原子质量:Na=23 Fe=56H=1 C=12 O=16 )( )
| A. | 1 mol Na2O2固体中含离子总数为3NA | |
| B. | 0.10 mol Fe粉与足量水蒸气反应生成的H2分子数为0.10NA | |
| C. | 40g NaOH溶于1L水中,所得NaOH 溶液的物质的量浓度为1mol/L | |
| D. | 标准状况下,11.2L苯中含有分子的数目为0.5NA |
20. 天然气含有硫化氢气体,回收并综合利用硫化氢有重要的经济价值和环境保护意义.如硫化氢可经过一系列反应制得硫酸:
天然气含有硫化氢气体,回收并综合利用硫化氢有重要的经济价值和环境保护意义.如硫化氢可经过一系列反应制得硫酸:
H2S$→_{点燃}^{O_{2}}$SO2$\stackrel{H_{2}O}{→}$H2SO3$\stackrel{氧化}{→}$H2SO4
(1)物质发生不完全燃烧时的反应热难以通过实验测得.已知硫化氢气体的燃烧热是586kJ/mol,固体硫单质的燃烧热是297 kJ•mol-1.写出硫化氢气体不完全燃烧生成固体硫单质的热化学方程式H2S(g)+$\frac{1}{2}$O2(g)=S(s)+H2O (l)△H=-279kJ/mol.
(2)工业生产中硫化氢尾气可用NaOH溶液吸收.
①吸收尾气后得到的Na2S溶液显碱性(填“酸”、“碱”、“中”);
②下列与H2S、NaHS和Na2S相关的离子方程式正确的是(填字母序号)AC.
A.H2S+OH-=HS-+H2O
B.HS-+H2O=H2S+OH-
C.HS-+H2O?S2-+H3O+
D.S2-+H2O?H2S+2OH-
(3)在一定温度下,某容器中发生2H2S(g)?2H2(g)+S2(g)的反应,测得相应时间时部分物质的浓度(mol•L-1)如下表,根据表中数据回答问题:
①判断90min时反应速率v(正)= v(逆)(填“>”、“=”或“<”);
②求该温度下反应的化学平衡常数(不必写出计算过程)K=0.0025 mol•L-1.
(4)以硫化氢为原料,使用质子固体电解质(能传导H+)构成燃料电池,硫化氢放电后生成硫蒸气(化学式S2),该燃料电池的负极反应式为2H2S-4e-=S2+4H+.
(5)硫酸是强酸,在图中画出硫酸溶液和氢氧化钠溶液反应过程的能量变化示意图.
 天然气含有硫化氢气体,回收并综合利用硫化氢有重要的经济价值和环境保护意义.如硫化氢可经过一系列反应制得硫酸:
天然气含有硫化氢气体,回收并综合利用硫化氢有重要的经济价值和环境保护意义.如硫化氢可经过一系列反应制得硫酸:H2S$→_{点燃}^{O_{2}}$SO2$\stackrel{H_{2}O}{→}$H2SO3$\stackrel{氧化}{→}$H2SO4
(1)物质发生不完全燃烧时的反应热难以通过实验测得.已知硫化氢气体的燃烧热是586kJ/mol,固体硫单质的燃烧热是297 kJ•mol-1.写出硫化氢气体不完全燃烧生成固体硫单质的热化学方程式H2S(g)+$\frac{1}{2}$O2(g)=S(s)+H2O (l)△H=-279kJ/mol.
(2)工业生产中硫化氢尾气可用NaOH溶液吸收.
①吸收尾气后得到的Na2S溶液显碱性(填“酸”、“碱”、“中”);
②下列与H2S、NaHS和Na2S相关的离子方程式正确的是(填字母序号)AC.
A.H2S+OH-=HS-+H2O
B.HS-+H2O=H2S+OH-
C.HS-+H2O?S2-+H3O+
D.S2-+H2O?H2S+2OH-
(3)在一定温度下,某容器中发生2H2S(g)?2H2(g)+S2(g)的反应,测得相应时间时部分物质的浓度(mol•L-1)如下表,根据表中数据回答问题:
时间 物质 | 0min | 20min | 60min | 90min | 120min |
| H2S | 0.006 | 0.005 | |||
| H2 | 0 | 0.002 | 0.004 | ||
| S2 | 0 | 0.002 | 0.0025 |
②求该温度下反应的化学平衡常数(不必写出计算过程)K=0.0025 mol•L-1.
(4)以硫化氢为原料,使用质子固体电解质(能传导H+)构成燃料电池,硫化氢放电后生成硫蒸气(化学式S2),该燃料电池的负极反应式为2H2S-4e-=S2+4H+.
(5)硫酸是强酸,在图中画出硫酸溶液和氢氧化钠溶液反应过程的能量变化示意图.
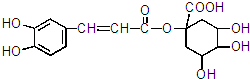 所示:
所示: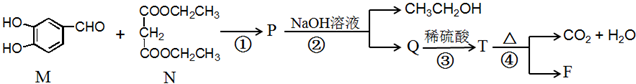

 .
.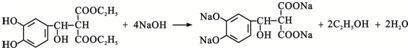 .
. .
.