5.下列与化学反应原理相关的叙述中,不正确的是( )
| A. | 2NO2((g)+O3(g)?N2O5(g)+O2(g)中N2O5既是氧化产物又是还原产物 | |
| B. | aA(s)+bB(g)=cC(g),若将容器体积增至原来2倍,C浓度降至原来的0.5倍,则a+b=c | |
| C. | 对于2SO2(g)+O2(g)?2SO3(g)的平衡体系,在温度、压强保持不变时充入少量SO3,则正反应速率减小、逆反应速率增大,平衡向逆反应方向移动 | |
| D. | 对于N2(g)+3H2(g)?2NH3(g)△H的平衡体系,仅将所有物质浓度加倍,平衡将向正反应方向移动,但△H不变 |
4.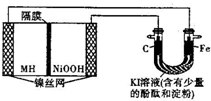 如图中的左侧装置是一种金属氢化物镍电池,其中的MH是吸附了氢原子的储氢合金,电解质溶液KOH.右侧装置是一电解池,电极材料及电解质溶液如图所示,下列有关此实验的叙述中,正确的是( )
如图中的左侧装置是一种金属氢化物镍电池,其中的MH是吸附了氢原子的储氢合金,电解质溶液KOH.右侧装置是一电解池,电极材料及电解质溶液如图所示,下列有关此实验的叙述中,正确的是( )
 如图中的左侧装置是一种金属氢化物镍电池,其中的MH是吸附了氢原子的储氢合金,电解质溶液KOH.右侧装置是一电解池,电极材料及电解质溶液如图所示,下列有关此实验的叙述中,正确的是( )
如图中的左侧装置是一种金属氢化物镍电池,其中的MH是吸附了氢原子的储氢合金,电解质溶液KOH.右侧装置是一电解池,电极材料及电解质溶液如图所示,下列有关此实验的叙述中,正确的是( )| A. | 放电时负极反应为:MH+OH-=M+H2O+e- | |
| B. | 充电时隔膜旁的OH-从右向左移动 | |
| C. | 右侧装置中的铁电极附近溶液呈蓝色 | |
| D. | 右侧装置中的碳电极表面逸出无色、无味的气体 |
3.下列实验装置设计合理,且能达到相应实验目的是:( )
| 选项 | 实验装置 | 实验目的 |
| A | 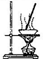 | 加热硫酸铜晶体获得无水硫酸铜 |
| B | 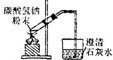 | 加热碳酸氢钠,证明它能分解释放出二氧化碳气体 |
| C |  | 实验室制取氯气 |
| D | 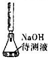 | 用中和滴定的方法测定某氢氧化钠待测液的浓度 |
| A. | A | B. | B | C. | C | D. | D |
2.常温时在指定条件下的溶液中,下列各组粒子一定能大量共存的是( )
| A. | 加入Na2O2后的溶液中:K+、AlO2-、NO3-、SO32- | |
| B. | 水电离的c(H+ )=1×10-13 mol•L-1的溶液中:Fe2+、Mg 2+、SO42-、NO3- | |
| C. | 通入足量SO2后的溶液中:Ba2+、Fe2+、H2SO3、Cl- | |
| D. | 0.1mol•L-1 KMnO4酸性溶液中:H2O2、NH4+、Br2、SO4 2- |
1.将含有amol Na2CO3的纯碱溶液与含有b mol HCl的稀盐酸进行反应,若不考虑二氧化碳在水中的溶解,用NA表示阿伏加德罗常数的数值,则下列相关叙述中,正确的是( )
| A. | 此纯碱溶液中含有CO${\;}_{3}^{2-}$的数目为aNA | |
| B. | 若a<b<2a,生成标准状况下二氧化碳的体积可能是11.2b L或22.4(b-a)L | |
| C. | 若b≥2a,则两溶液相互滴加的顺序不同,反应生成的二氧化碳分子数目不同 | |
| D. | 若b≤a,则无论两溶液相互滴有加的顺序如何,反应过程中均有气泡产生 |
18.生活中的下列现象,属于化学变化的是( )
| A. | 玻璃破碎 | B. | 冰雪融化 | C. | 食物腐败 | D. | 衣服晾干 |
17.下列分子中的所有碳原子均在同一条直线上的是( )
| A. | CH3CH2CH2CH3 | B. | CH3-CH=CHCH3 | C. | HC≡C-CH2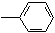 | D. | CH3-C≡C-C≡C-CH3 |
16.下列说法正确的是( )
0 167213 167221 167227 167231 167237 167239 167243 167249 167251 167257 167263 167267 167269 167273 167279 167281 167287 167291 167293 167297 167299 167303 167305 167307 167308 167309 167311 167312 167313 167315 167317 167321 167323 167327 167329 167333 167339 167341 167347 167351 167353 167357 167363 167369 167371 167377 167381 167383 167389 167393 167399 167407 203614
| A. | 用元素分析仪确定有机化合物的组成时具有所需样品量小,分析速度快的优点 | |
| B. | 钠融法可以定性确定有机物中是否含有C、H、O等元素 | |
| C. | 测定有机化合物组成元素的方法还有核磁共振、红外光谱等方法 | |
| D. | 甲醚和乙醇是同分异构体,它们在核磁共振谱中出现的特征峰分别是1个和2个 |
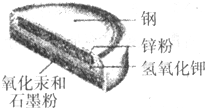 某种钮扣电池的剖面结构如图所示.请回答下列问题:
某种钮扣电池的剖面结构如图所示.请回答下列问题: