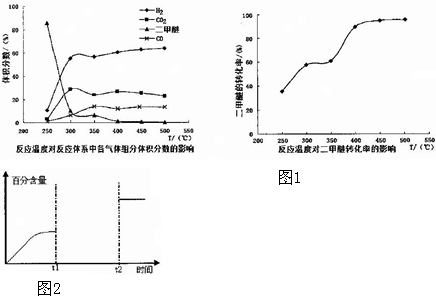
题目内容
5.下列与化学反应原理相关的叙述中,不正确的是( )| A. | 2NO2((g)+O3(g)?N2O5(g)+O2(g)中N2O5既是氧化产物又是还原产物 | |
| B. | aA(s)+bB(g)=cC(g),若将容器体积增至原来2倍,C浓度降至原来的0.5倍,则a+b=c | |
| C. | 对于2SO2(g)+O2(g)?2SO3(g)的平衡体系,在温度、压强保持不变时充入少量SO3,则正反应速率减小、逆反应速率增大,平衡向逆反应方向移动 | |
| D. | 对于N2(g)+3H2(g)?2NH3(g)△H的平衡体系,仅将所有物质浓度加倍,平衡将向正反应方向移动,但△H不变 |
分析 A、化合价降低的元素所在的产物是还原产物,化合价升高元素所在的产物是氧化产物;
B、容器体积扩大,容器内气体的浓度减小,根据压强对平衡移动的影响来判断;
C、根据影响化学反应速率的因素以及影响化学平衡移动的因素来回答判断;
D、将平衡体系中所有物质浓度加倍,相当于加压,根据压强对平衡移动的影响以及焓变的影响因素来判断.
解答 解:A、2NO2((g)+O3(g)?N2O5(g)+O2(g)中,化合价降低的氧元素所在的产物N2O5是还原产物,化合价升高的N元素所在的产物N2O5是氧化产物,故A正确;
B、容器体积扩大,容器内气体的浓度减小,将容器体积增至原来2倍,C浓度降至原来的0.5倍,则b=c,A是固体,其量的多少不影响体系的压强,故B错误;
C、对于2SO2(g)+O2(g)?2SO3(g)的平衡体系,在温度、压强保持不变时充入少量SO3,则体积增大,反应物浓度减小,正反应速率减小,增加了产物浓度,逆反应速率增大,平衡向逆反应方向移动,故C正确;
D、将平衡体系中所有物质浓度加倍,相当于加压,平衡将向正反应方向移动,但△H和各个物质的浓度大小无关,所以焓变不变,故D正确.
故选B.
点评 本题考查学生影响化学反应速率和化学平衡移动的因素知识,注意知识的归纳和梳理是关键,难度不大.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
14.下列化学用语的书写,正确的是( )
| A. | 氯原子的结构示意图: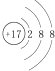 | |
| B. | 6个质子8个中子的碳元素的核素符号:12C | |
| C. | 氯化镁的电子式:[${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$]-Mg2+[${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$]- | |
| D. | 用电子式表示氯化氢的形成过程:H•+•$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$→H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$]- |
13.化学与社会、生活密切相关,对下列现象或事实的解释正确的是( )
| 选项 | 现象或事实 | 解释 |
A | Al(OH)3用作塑料的阻燃剂 | Al(OH)3受热熔化放出大量的热 |
| B | 用氢氟酸蚀刻玻璃 | SiO2是碱性氧化物,能溶于酸 |
| C | 过氧化钠作呼吸面具中的供氧剂 | 过氧化钠是强氧化剂,能氧化二氧化碳 |
| D | 用浸有酸性高锰酸钾溶液的硅藻 土作水果保鲜剂 | 酸性高锰酸钾溶液能氧化水果释放的催熟剂乙烯 |
| A. | A | B. | B | C. | C | D. | D |
10.在化学学习中,类推思维是化学学习中常用的一种思维方法.下列类推正确的是( )
| 已知 | 类推 | |
| A | 离子是带电荷的粒子 | 带电荷的粒子一定是离子 |
| B | 稀硫酸作电解质溶液时,氢氧燃料电池的负极反应为 2H2-4e-=4H+ | 氢氧化钾溶液作电解质溶液时,氢氧燃料电池的负极反应为2H2-3e-+4OH-=4H2O |
| C | 将Fe加入到CuSO4溶液中 Fe+Cu2+=Cu+Fe2+ | 将Na加入到CuSO4溶液中 2Na+Cu2+=Cu+2Na+ |
| D | 原电池中通常是活泼金属做负极,不活泼金属做正极 | 铜和铝与浓硝酸构成原电池时,铜是正极 |
| A. | A | B. | B | C. | C | D. | D |
17.某有机物X的结构简式为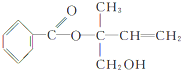 ,则下列有关说法正确的是( )
,则下列有关说法正确的是( )
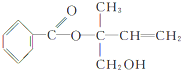 ,则下列有关说法正确的是( )
,则下列有关说法正确的是( )| A. | X的分子式为C12H16O3 | |
| B. | X在一定条件下能发生加成、加聚、取代、消去等反应 | |
| C. | 可用酸性高锰酸钾溶液区分苯和X | |
| D. | 在Ni作催化剂的条件下,1molX最多只能与1molH2加成 |
14.X、Y、Z、W是浓度均为0.01mol/L的溶液,其溶质分别是HCl、NH4Cl、NaOH、NaF中的某一种.室温下,溶液的pH如下表:下列说法正确的是( )
| 溶液 | X | Y | Z | W |
| pH | 12 | 2 | 7.7 | 5.6 |
| A. | 将Z溶液加水稀释至浓度为0.001mol/L,所得溶液pH=6.7 | |
| B. | 四种溶液中,水的电离程度最大的是W溶液 | |
| C. | 将X、W溶液按1:2的体积比混合,所得溶液中:c(H+)>c(OH-) | |
| D. | 将11mLX溶液与9mLY溶液混合(忽略混合时体积的变化),所得溶液pH=10 |
15.下列说法不正确的是( )
| A. | 常温下,在0.1mol•L-1的HNO3溶液中,由水电离出的c(H+)<$\sqrt{{K}_{W}}$ | |
| B. | 浓度为0.1mol•L-1的NaHCO3溶液:c(H2CO3)>c(CO32-) | |
| C. | 25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同 | |
| D. | 冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小 |