题目内容
4.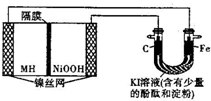 如图中的左侧装置是一种金属氢化物镍电池,其中的MH是吸附了氢原子的储氢合金,电解质溶液KOH.右侧装置是一电解池,电极材料及电解质溶液如图所示,下列有关此实验的叙述中,正确的是( )
如图中的左侧装置是一种金属氢化物镍电池,其中的MH是吸附了氢原子的储氢合金,电解质溶液KOH.右侧装置是一电解池,电极材料及电解质溶液如图所示,下列有关此实验的叙述中,正确的是( )| A. | 放电时负极反应为:MH+OH-=M+H2O+e- | |
| B. | 充电时隔膜旁的OH-从右向左移动 | |
| C. | 右侧装置中的铁电极附近溶液呈蓝色 | |
| D. | 右侧装置中的碳电极表面逸出无色、无味的气体 |
分析 镍氢电池放电时,正极:NiOOH+H2O+e-=Ni(OH)2+OH-,负极:MH+OH--e-=M+H2O,总反应:MH+NiOOH=M+Ni(OH)2 ,电解池中,在阴极上是氢离子得电子的还原反应,在阳极上是碘离子失电子的氧化反应,据此回答.
解答 解:A、镍氢电池放电时,负极发生失电子的氧化反应,即:MH+OH--e-=M+H2O,故A正确;
B、镍氢电池放电时,正极:NiOOH+H2O+e-=Ni(OH)2+OH-,负极:MH+OH--e-=M+H2O,所以左边电极是负极,右边电极是正极,充电时隔膜旁的OH-从阴极移向阳极,即从左到右移动,故B错误;
C、右侧装置中的铁电极是阴极,该电极上是氢离子得电子的还原反应,电极附近碱性增强,不会产生碘单质,溶液呈红色,故C错误;
D、右侧装置中的碳电极是阳极,该电极上是碘离子失电子的氧化反应,产生的碘单质不是气体,故D错误.
故选A.
点评 本题考查了原电池和电解池原理,明确题给信息的含义是解本题关键,难点的电极反应式的书写,题目难度中等.

练习册系列答案
相关题目
13.有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如表:
由此可判断这四种金属的活动性顺序是( )
| 实验 装置 |  | 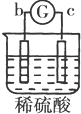 | 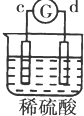 | 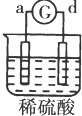 |
| 部分实验现象 | a极质量减小b极质量增加 | c极有气体产生 b极质量减轻 | d极溶解c极有气体产生 | 电流从a极流向d极 |
| A. | a>b>c>d | B. | b>c>d>a | C. | d>a>b>c | D. | a>b>d>c |
15.某溶液可能含有NH4+、K+、Ba2+、Fe3+、I-、SO32-、SO42-中的几种,现取100mL溶液加入少量溴水,溶液呈无色.继续滴加足量HNO3和Ba(NO3)2混合溶液,产生沉淀,沉淀经洗涤、高温干燥后质量为4.66g.滤液加足量NaOH溶液、加热,生成气体在标准状况下体积为1120mL.根据上述实验,以下推测正确的是( )
| A. | 原溶液肯定只存在NH4+、SO32- | |
| B. | 原溶液一定不含Ba2+、Fe3+、I- | |
| C. | 原溶液可能存在K+、SO42- | |
| D. | 另取试液滴加足量盐酸、BaCl2溶液,即可确定溶液离子组成 |
16.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 71gNa2SO4固体中含钠离子数目为NA | |
| B. | 28g由乙烯和丙烯组成的混合气体中含碳碳双键数目为NA | |
| C. | 标准状况下,22.4LHF中含HF分子数目为NA | |
| D. | 25g质量分数为68%的H2O2水溶液中含氧原子数目为NA |
13.下述实验能达到预期实验目的是( )
| 序号 | 实验内容 | 实验目的 |
| A | 向盛有10滴0.1 mol•L-1AgNO3溶液的试管中滴加0.1mol•L-1 NaCl溶液,至不再有沉淀生成,再向其中滴加0.1mol•L-1 Na2S溶液 | 证明AgCl能转化为溶解度更小的Ag2S |
| B | 取某溶液少量,加入盐酸酸化的氯化钡溶液,出现白色沉淀 | 证明该溶液中一定含有大量的SO42- |
| C | 向某卤代烃中加入NaOH溶液,加热一段时间后,加入AgNO3溶液 | 检验卤代烃中的卤素原子 |
| D | 向纯碱中滴加足量盐酸,将产生的气体通入苯酚钠溶液 | 证明酸性:盐酸>碳酸>苯酚 |
| A. | A | B. | B | C. | C | D. | D |
14.下列图示实验操作正确的是( )
| A. | 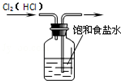 除去Cl2中的HCl | B. | 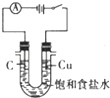 电解制Cl2和H2 | C. | 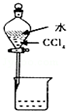 分离CCl4和水 | D. | 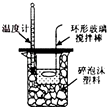 中和热的测定 |

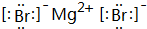
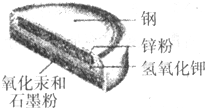 某种钮扣电池的剖面结构如图所示.请回答下列问题:
某种钮扣电池的剖面结构如图所示.请回答下列问题: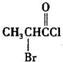 、
、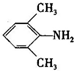 是合成施安卡因(
是合成施安卡因(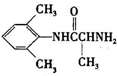 ,一种抗心律失学药物)的中间体,分别由如图所示路线合成:
,一种抗心律失学药物)的中间体,分别由如图所示路线合成: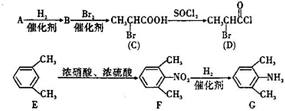 ,已知氨基(-NH2)、亚氨基(-NH-)均有碱性.
,已知氨基(-NH2)、亚氨基(-NH-)均有碱性.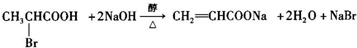 ;
;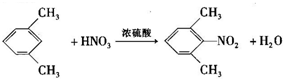 ;
; ;
;