题目内容
16.下列说法正确的是( )| A. | 用元素分析仪确定有机化合物的组成时具有所需样品量小,分析速度快的优点 | |
| B. | 钠融法可以定性确定有机物中是否含有C、H、O等元素 | |
| C. | 测定有机化合物组成元素的方法还有核磁共振、红外光谱等方法 | |
| D. | 甲醚和乙醇是同分异构体,它们在核磁共振谱中出现的特征峰分别是1个和2个 |
分析 A.元素分析仪特点是样品量小,速度快;
B.钠融法:将有机样品与金属钠混合熔融,氮、氯、溴、硫等元素分别以氰化钠、氯化钠、溴化钠、硫化钠等的形式存在,再用无机定性分析法测定;
C.确定有机化合物的元素组成的方法:李比希法、钠融法、铜丝燃烧法、元素分析仪法;
D.分子中有几种氢原子,核磁共振氢谱有几个峰.
解答 解:A.元素分析仪可同时对有机物中碳、氢、氧、硫等多种元素进行分析,其特点是样品量小,速度快,故A正确;
B.钠融法:将有机样品与金属钠混合熔融,氮、氯、溴、硫等元素分别以氰化钠、氯化钠、溴化钠、硫化钠等的形式存在,再用无机定性分析法测定,钠融法不能定性确定有机物中是否含有C、H、O等元素,故B错误;
C.核磁共振和红外光谱法用于测定有机物中氢原子的种类和有机物中含有的化学键类型,故C错误;
D.甲醚为CH3-O-CH3,乙醇结构式为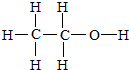 ,左边3个氢原子是一种,右边碳上氢原子一种,羟基上一中,有3种氢原子,特征峰是3个,故D错误.
,左边3个氢原子是一种,右边碳上氢原子一种,羟基上一中,有3种氢原子,特征峰是3个,故D错误.
故选A.
点评 本题考查化学研究基本方法及作用,掌握物质的研究方法是解题的关键,难度不大.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
5.下列关于元素周期律的说法正确的是( )
| A. | 酸性强弱:H3PO4<H2SO4 | B. | 稳定性:HF>H2S | ||
| C. | 碱性:Ca(OH)2<Mg(OH)2 | D. | 非金属性:N<Si |
7.已知下表均为烷烃分子的化学式,且它们的一元取代物只有一种,问第五项烷烃化学式为( )
| 1 | 2 | 3 | 4 | 5 | 6 | … |
| CH4 | C2H6 | C5H12 | C8H18 | … | … | … |
| A. | C26H54 | B. | C17H36 | C. | C80H162 | D. | C106H214 |
4.将一定量的氯气通入氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3的共存体系.下列判断不正确的是( )
| A. | 参加反应所需NaOH与氯气的物质的量之比一定为2:1 | |
| B. | 反应体系中n(NaCl):n(NaClO):n(NaC1O3)(物质的量之比)可能为11:1:2 | |
| C. | 若反应有amol氯气参加反应,则amol<转移电子数<$\frac{5a}{3}$mol | |
| D. | 反应中NaC1O和NaClO3为氧化产物,且物质的量之比一定为l:1 |
11.图表示汽车尾气净化处理过程,有关叙述正确的是( )


| A. | 上述过程中,NOX只被CO还原 | |
| B. | 安装该净化器的汽车使用含铅汽油不会造成污染 | |
| C. | 产生22.4L氮气(标准状况)时,转移4xmole- | |
| D. | Pt-Rh催化剂可提高尾气平衡转化率 |
1.将含有amol Na2CO3的纯碱溶液与含有b mol HCl的稀盐酸进行反应,若不考虑二氧化碳在水中的溶解,用NA表示阿伏加德罗常数的数值,则下列相关叙述中,正确的是( )
| A. | 此纯碱溶液中含有CO${\;}_{3}^{2-}$的数目为aNA | |
| B. | 若a<b<2a,生成标准状况下二氧化碳的体积可能是11.2b L或22.4(b-a)L | |
| C. | 若b≥2a,则两溶液相互滴加的顺序不同,反应生成的二氧化碳分子数目不同 | |
| D. | 若b≤a,则无论两溶液相互滴有加的顺序如何,反应过程中均有气泡产生 |
5.有机物甲、乙、丙(CH3COOC2H5)、丁 (CH3 CHO)与乙醇的转化关系如图所示.下列判断不正确的是( )


| A. | 甲是乙烯 | B. | 乙可能是葡萄糖 | ||
| C. | 丙与NaOH溶液反应不能生成乙醇 | D. | 丁十H2→乙醇的反应属于加成反应 |
6.尿素是蛋白质代谢的产物,也是重要的化学肥料.工业合成尿素反应如下:
2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)
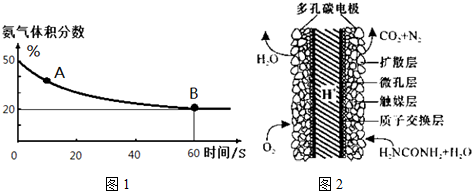
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图1所示.A点的正反应速率v正(CO2)>B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);
氨气的平衡转化率为75%.
(2)氨基甲酸铵是合成尿素的一种中间产物.将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)═NH2COONH4(s)
将实验测得的不同温度下的平衡数据列于下表:
①关于上述反应的焓变、熵变说法正确的是A.
A.△H<0,△S<0B.△H>0,△S<0 C.△H>0,△S>0D.△H<0,△S>0
②关于上述反应的平衡状态下列说法正确的是C
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
③氨基甲酸铵极易水解成碳酸铵,酸性条件水解更彻底.将氨基甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素.
此时溶液中c(NH4+)=0.1mol/L;
NH4+水解平衡常数值为4×10-9.
(3)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电.尿素燃料电池结构如图2所示,写出该电池的负极反应式:CO(NH2)2+H2O-6e-=CO2+N2+6H+.
2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)

(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图1所示.A点的正反应速率v正(CO2)>B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);
氨气的平衡转化率为75%.
(2)氨基甲酸铵是合成尿素的一种中间产物.将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)═NH2COONH4(s)
将实验测得的不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.△H<0,△S<0B.△H>0,△S<0 C.△H>0,△S>0D.△H<0,△S>0
②关于上述反应的平衡状态下列说法正确的是C
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
③氨基甲酸铵极易水解成碳酸铵,酸性条件水解更彻底.将氨基甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素.
此时溶液中c(NH4+)=0.1mol/L;
NH4+水解平衡常数值为4×10-9.
(3)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电.尿素燃料电池结构如图2所示,写出该电池的负极反应式:CO(NH2)2+H2O-6e-=CO2+N2+6H+.
 我国黄铁矿(主要成分:FeS2、SiO2)储量丰富,目前主要利用黄铁矿资源生产硫酸等无机化工产品.
我国黄铁矿(主要成分:FeS2、SiO2)储量丰富,目前主要利用黄铁矿资源生产硫酸等无机化工产品. ①烧渣用稀硫酸浸取时有单质硫生成,生成单质硫的一步化学反应方程式为H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4;
①烧渣用稀硫酸浸取时有单质硫生成,生成单质硫的一步化学反应方程式为H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4;