题目内容
17.下列分子中的所有碳原子均在同一条直线上的是( )| A. | CH3CH2CH2CH3 | B. | CH3-CH=CHCH3 | C. | HC≡C-CH2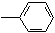 | D. | CH3-C≡C-C≡C-CH3 |
分析 在常见的有机化合物中甲烷是正四面体结构,乙烯和苯是平面型结构,乙炔是直线型结构,其它有机物可在此基础上进行判断.
解答 解:A.CH3CH2CH2CH3是锯齿形分子,所有的碳原子不可能在同一条直线上,故A错误;
B.乙烯是平面型结构,CH3-CH=CHCH3中四碳原子都在同一平面上,不可能在同一条直线上,故B错误;
C.苯是平面型结构,乙炔是直线型结构,HC≡C-CH2
D.乙炔是直线型结构,CH3-C≡C-C≡C-CH3中所有碳原子均在同一条直线上,故D正确.
故选D.
点评 本题考查物质结构,做题时注意从甲烷、乙烯、苯的结构特点判断有机分子的空间结构及其原子是否共线,难度中等.

练习册系列答案
相关题目
6.含硒(Se)的保健品已开始进入市场.已知硒与氧、硫同主族,与溴同周期,则下列关于硒的叙述中,正确的是( )
| A. | 非金属性比硫弱 | B. | 氢化物比HBr稳定 | ||
| C. | 原子序数为34 | D. | 最高价氧化物的水化物显碱性 |
2.常温时在指定条件下的溶液中,下列各组粒子一定能大量共存的是( )
| A. | 加入Na2O2后的溶液中:K+、AlO2-、NO3-、SO32- | |
| B. | 水电离的c(H+ )=1×10-13 mol•L-1的溶液中:Fe2+、Mg 2+、SO42-、NO3- | |
| C. | 通入足量SO2后的溶液中:Ba2+、Fe2+、H2SO3、Cl- | |
| D. | 0.1mol•L-1 KMnO4酸性溶液中:H2O2、NH4+、Br2、SO4 2- |

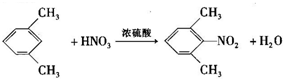
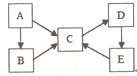 构建知识网络体系,有助于知识的有序储存和应用.下图A、B、C、D、E五种物质均含有同一种元素,它们之间有如图转化关系:
构建知识网络体系,有助于知识的有序储存和应用.下图A、B、C、D、E五种物质均含有同一种元素,它们之间有如图转化关系: .
.
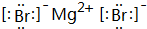
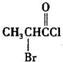 、
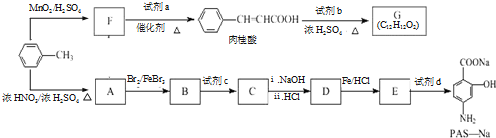
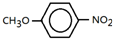
、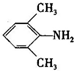 是合成施安卡因(
是合成施安卡因(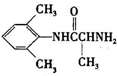 ,一种抗心律失学药物)的中间体,分别由如图所示路线合成:
,一种抗心律失学药物)的中间体,分别由如图所示路线合成: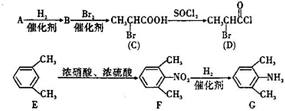 ,已知氨基(-NH2)、亚氨基(-NH-)均有碱性.
,已知氨基(-NH2)、亚氨基(-NH-)均有碱性.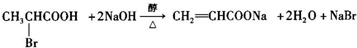 ;
; ;
; ;
;


 ;
; ;
; .
.