题目内容
1.将含有amol Na2CO3的纯碱溶液与含有b mol HCl的稀盐酸进行反应,若不考虑二氧化碳在水中的溶解,用NA表示阿伏加德罗常数的数值,则下列相关叙述中,正确的是( )| A. | 此纯碱溶液中含有CO${\;}_{3}^{2-}$的数目为aNA | |
| B. | 若a<b<2a,生成标准状况下二氧化碳的体积可能是11.2b L或22.4(b-a)L | |
| C. | 若b≥2a,则两溶液相互滴加的顺序不同,反应生成的二氧化碳分子数目不同 | |
| D. | 若b≤a,则无论两溶液相互滴有加的顺序如何,反应过程中均有气泡产生 |
分析 A、碳酸钠中碳酸根离子会水解;
B、碳酸钠可以和盐酸反应生成碳酸氢钠,还可以和盐酸反应产生二氧化碳,产物取决于盐酸和碳酸钠的物质的量的相对多少;
C、碳酸钠可以和过量的盐酸反应生成氯化钠、水以及二氧化碳;
D、碳酸钠可以和少量的盐酸反应生成碳酸氢钠,不会产生气体.
解答 解:A、碳酸钠中碳酸根离子会水解,所以amol纯碱溶液中碳酸根离子的物质的量小于amol,数目小于aNA,故A错误;
B、碳酸钠可以和盐酸反应生成碳酸氢钠,还可以和盐酸反应产生二氧化碳,如果a<b<2a,则盐酸会全部反应,根据Na2CO3+2HCl=2NaCl+H2O+CO2↑,产生二氧化碳是0.5bmol,体积是11.2bL,如果发生下面的过程:
Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+H2O+CO2↑,
amol amol amol (b-a)mol (b-a)mol (b-a)mol
生成标准状况下二氧化碳的体积可能22.4(b-a)L,故B正确;
C、碳酸钠可以和过量的盐酸反应生成氯化钠、水以及二氧化碳,若b≥2a,则盐酸过量,所以两溶液相互滴加的顺序不同,最终反应生成的二氧化碳分子数目相同,故C错误;
D、若b≤a,只会发生反应:Na2CO3+HCl=NaHCO3+NaCl,则无论两溶液相互滴有加的顺序如何,反应过程中均没有气泡产生,故D错误.
故选B.
点评 本题考查学生物质间的化学反应以及量的多少之间的关系知识,注意发生的化学反应以及量的应用是关键,难度中等.

练习册系列答案
相关题目
12.下列说法正确的是( )
| A. | 化合物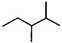 按系统命名法的名称为2,3一二甲基丁烷 按系统命名法的名称为2,3一二甲基丁烷 | |
| B. | 淀粉和纤维素的化学式均为(C6H10O5)n,二者互为同分异构体 | |
| C. | 等质量的聚乙烯、甲烷、乙烯分别充分燃烧,所耗氧气的量依次减少 | |
| D. | 通常用酒精消毒,其原理是酒精使细菌中的蛋白质变性而失去生理活性 |
9.利尿酸的结构简式如下图.下列有关利尿酸的说法不正确的是( )


| A. | 分子式是C13H14O4Cl2 | |
| B. | 一定条件下能发生消去反应 | |
| C. | -定条件下能发生加聚反应 | |
| D. | 1mol利尿酸最多能与5molH2发生加成反应 |
16.下列说法正确的是( )
| A. | 用元素分析仪确定有机化合物的组成时具有所需样品量小,分析速度快的优点 | |
| B. | 钠融法可以定性确定有机物中是否含有C、H、O等元素 | |
| C. | 测定有机化合物组成元素的方法还有核磁共振、红外光谱等方法 | |
| D. | 甲醚和乙醇是同分异构体,它们在核磁共振谱中出现的特征峰分别是1个和2个 |
6.下列说法正确的是( )
| A. | Ksp(AB2)小于Ksp(CD),说明AB2的溶解度一定小于CD的溶解度 | |
| B. | 除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 | |
| C. | 2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,此反应能够进行是因为碳的还原性比硅强 | |
| D. | 弱酸也可以通过复分解反应制强酸,如:H2S+CuSO4=H2SO4+CuS↓ |
10.下列关于物质用途的说法正确的是( )
| A. | 硫酸铁可用作净水剂 | B. | 二氧化硅可用作计算机芯片 | ||
| C. | 铜制容器可用于盛装浓硝酸 | D. | 醋酸铅可用于分离提纯蛋白质 |
11.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 常温常压下,14 g C2H4、C3H6的混合气体中含有碳原子的数目为NA | |
| B. | 常温下,pH=12的Na2CO3溶液中含有的OH-离子数为0.01NA | |
| C. | 标准状况下,0.56 L丙烷中含有共价键的数目为0.2 NA | |
| D. | 7.8 g Na2O2中含有的阴离子数为0.2NA |
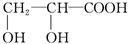 乙:
乙: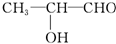
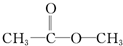 丁:
丁: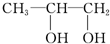
 水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题: