题目内容
2.常温时在指定条件下的溶液中,下列各组粒子一定能大量共存的是( )| A. | 加入Na2O2后的溶液中:K+、AlO2-、NO3-、SO32- | |
| B. | 水电离的c(H+ )=1×10-13 mol•L-1的溶液中:Fe2+、Mg 2+、SO42-、NO3- | |
| C. | 通入足量SO2后的溶液中:Ba2+、Fe2+、H2SO3、Cl- | |
| D. | 0.1mol•L-1 KMnO4酸性溶液中:H2O2、NH4+、Br2、SO4 2- |
分析 A.过氧化钠具有强氧化性,能够氧化亚硫酸根离子;
B.水电离的c(H+ )=1×10-13 mol•L-1的溶液中存在大量氢离子或氢氧根离子,镁离子、铜离子与氢氧根离子反应;
C.四种粒子之间不发生反应,通入二氧化硫后也不反应;
D.酸性高锰酸钾具有强氧化性,能够氧化双氧水.
解答 解:A.SO32-与Na2O2发生氧化还原反应,二者不能大量共存,故A错误;
B.水电离的c(H+ )=1×10-13 mol•L-1的溶液为酸性或碱性溶液,溶液中存在大量氢离子或氢氧根离子,Fe2+、Mg 2+与氢氧根离子反应,在溶液中不能大量共存,故B错误;
C.Ba2+、Fe2+、H2SO3、Cl-之间不反应,通入二氧化硫后也不反应,能够大量共存,故C正确;
D.KMnO4、H2O2之间发生氧化还原反应,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;是“可能”共存,还是“一定”共存等.

练习册系列答案
相关题目
13.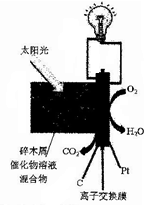 日前,美国科学家开发出一种直接以生物质为原料的低温燃料电池.将木屑(主要成分为纤维素)磨碎后与一种多金属氧酸盐催化物溶液相混合,置于阳光或热辐射下就会开始工作(如图所示).关于该电池说法错误的是( )
日前,美国科学家开发出一种直接以生物质为原料的低温燃料电池.将木屑(主要成分为纤维素)磨碎后与一种多金属氧酸盐催化物溶液相混合,置于阳光或热辐射下就会开始工作(如图所示).关于该电池说法错误的是( )
 日前,美国科学家开发出一种直接以生物质为原料的低温燃料电池.将木屑(主要成分为纤维素)磨碎后与一种多金属氧酸盐催化物溶液相混合,置于阳光或热辐射下就会开始工作(如图所示).关于该电池说法错误的是( )
日前,美国科学家开发出一种直接以生物质为原料的低温燃料电池.将木屑(主要成分为纤维素)磨碎后与一种多金属氧酸盐催化物溶液相混合,置于阳光或热辐射下就会开始工作(如图所示).关于该电池说法错误的是( )| A. | 该电池为生物质能的利用提供了一个很好的途径 | |
| B. | 该离子交换膜为质子交换膜 | |
| C. | 电源负极周围溶液的pH值升高 | |
| D. | 碎木屑发生氧化反应:(C6H10O5)n+7nH2O-24ne-=6nCO2↑+24nH+ |
10.室温下,下列溶液中粒子浓度关系正确的是( )
| A. | 0.1mol/LNa2CO3溶液中:2c(Na+)=c(HCO3-)+c(H2CO3)+c(C032-) | |
| B. | 向0.1mol/L氯化铵溶液中滴加浓盐酸可能有c(NH4+)=c(H+) | |
| C. | pH=4的醋酸与pH=10的NaOH溶液等体积混合后pH>7 | |
| D. | 将0.2mol/LNaA溶液和某浓度的盐酸等体积混合所得中性溶液中:c(Na+)=c(A-)+c(Cl-)=0.2mol/L |
17.下列分子中的所有碳原子均在同一条直线上的是( )
| A. | CH3CH2CH2CH3 | B. | CH3-CH=CHCH3 | C. | HC≡C-CH2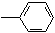 | D. | CH3-C≡C-C≡C-CH3 |
7.常温常压下,下列表示溶液中粒子浓度或物质的量和各种关系中,正确的是( )
| A. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:2c(Na+ )=3[c(HC2O4- )+c(C2O42-)+c(H2C2O4)] | |
| B. | pH=4.3的NaHC2O4溶液中:c(Na+ )>c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| C. | 0.10mol•L-1NaHCO3溶液中:c(Na+ )+c(H+ )=c(OH- )+c(HCO3-)+c(CO32-) | |
| D. | 0.10mol•L-1 NaHCO3溶液加水稀释后,n(H+ )与n(OH- )的乘积不变 |
11.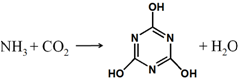 CO2的资源化利用是解决温室效应的重要途径,如图是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰酸的反应.下列有关三聚氰酸的说法正确的是( )
CO2的资源化利用是解决温室效应的重要途径,如图是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰酸的反应.下列有关三聚氰酸的说法正确的是( )
 CO2的资源化利用是解决温室效应的重要途径,如图是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰酸的反应.下列有关三聚氰酸的说法正确的是( )
CO2的资源化利用是解决温室效应的重要途径,如图是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰酸的反应.下列有关三聚氰酸的说法正确的是( )| A. | 分子式为C3H6N3O3 | B. | 分子中既含有σ键又含有π键 | ||
| C. | 分子中既含极性键,又含非极性键 | D. | 生成该物质的上述反应为中和反应 |
12.下列反应的离子方程式正确的是( )
| A. | 向明矾溶液中加入足量的烧碱溶液:Al3++3OH-=Al(OH)3↓ | |
| B. | 在含有等物质的量的Fe(NO3)2和KI组成的混合溶液中滴入稀盐酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O | |
| C. | 碳酸氢铵溶液中滴加足量的NaOH溶液:HCO3-+OH-=CO32-+H2O | |
| D. | 纯碱溶液呈碱性的原因:CO32-+H2O?HCO3-+OH- |
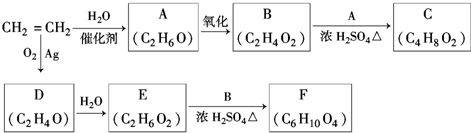
 ,该反应的类型为酯化反应;
,该反应的类型为酯化反应;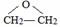 ;
;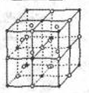 Ⅰ.第28届国际地质大会提供的资料显示,海底有大量的天然气水合物,可满足人类1000年的能源需要.天然气水合物是种晶体,晶体中平均每46个水分子构建成8个笼,每个笼可容纳1个CH4分子或1个游离H2O他子.根据上述信息,完成下面两题:
Ⅰ.第28届国际地质大会提供的资料显示,海底有大量的天然气水合物,可满足人类1000年的能源需要.天然气水合物是种晶体,晶体中平均每46个水分子构建成8个笼,每个笼可容纳1个CH4分子或1个游离H2O他子.根据上述信息,完成下面两题: ;
;