20.X、Y、Z、W、T是原子序数依次增大的前四个周期的元素,其中有两种是常见金属元素.其相关信息如表:
(1)X、Y、Z三种元素的电负性由大到小的顺序是O>C>Al(用元素符号表示,下同);在H-X、H-Y两种共价键中,键的极性较大的是H-O.
(2)T2+的电子排布式为1s22s22p63s23p63d6;T的单质在高温下与Y的氢化物反应,其化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;工业上用W的氧化物与X的单质高温下反应制得W单质的粗产品,其化学反应方程式为SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
(3)两种氢化物X2H2和H2Y2中沸点较高的是H2O2,两者沸点相差很大的原因是H2O2分子之间存在氢键,而C2H2分子之间为范德华力.
(4)在25℃、101kPa下,已知W稳定的气态氢化物在Y的气态单质中完全燃烧,恢复至原来状态,平均每消耗4gW稳定的气态氢化物放热190.0KJ,则该反应的热化学方程式SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)△H=-1520kJ/mol.
| 元素 | 相关信息 |
| X | X一种核素在考古时常用来坚定一些文物的年代 |
| Y | Y基态原子的s轨道电子与P轨道电子数相等 |
| Z | Z是所在周期的单核离子中半径最小 |
| W | W的单质被誉为“信息革命的催化剂”常用做半导体材料 |
| T | T有多种氧化物,其中一种纯净的氧化物可用来作录音磁带和 电讯器材的原材料 |
(2)T2+的电子排布式为1s22s22p63s23p63d6;T的单质在高温下与Y的氢化物反应,其化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;工业上用W的氧化物与X的单质高温下反应制得W单质的粗产品,其化学反应方程式为SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
(3)两种氢化物X2H2和H2Y2中沸点较高的是H2O2,两者沸点相差很大的原因是H2O2分子之间存在氢键,而C2H2分子之间为范德华力.
(4)在25℃、101kPa下,已知W稳定的气态氢化物在Y的气态单质中完全燃烧,恢复至原来状态,平均每消耗4gW稳定的气态氢化物放热190.0KJ,则该反应的热化学方程式SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)△H=-1520kJ/mol.
18.在容积固定不变的密闭容器中加入1mol N2和3mol H2发生反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,下列结论正确的是( )
| A. | 该反应达到平衡时,放出的热量等于92.4KJ | |
| B. | 达到平衡后向容器中通入1mol氦气,平衡不移动 | |
| C. | 降低温度和缩小容器体积均可使该反应的平衡常数增大 | |
| D. | 若达到平衡时N2的转化率为20%,则平衡时容器内的压强是起始时的80% |
16.短周期元素X、Y、Z、W的原子序数依次增大,X原子最外层电子数是电子层数的三倍,Y与X可形成Y2X2和Y2X两种离子化合物,Z原子的核外电子数比Y原子多1,W与X同主族,则( )
| A. | 原子半径:Y<Z<W | |
| B. | 单质的还原性:Y>Z | |
| C. | 气态氢化物的稳定性:X<W | |
| D. | Y和Z两者最高价氧化物对应的水化物能相互反应 |
14.下列各项中表达正确的是( )
0 167146 167154 167160 167164 167170 167172 167176 167182 167184 167190 167196 167200 167202 167206 167212 167214 167220 167224 167226 167230 167232 167236 167238 167240 167241 167242 167244 167245 167246 167248 167250 167254 167256 167260 167262 167266 167272 167274 167280 167284 167286 167290 167296 167302 167304 167310 167314 167316 167322 167326 167332 167340 203614
| A. | F的结构示意图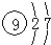 | B. | H2O的分子模型示意图 | ||
| C. | NaCl的电子式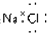 | D. | N2的结构式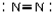 |
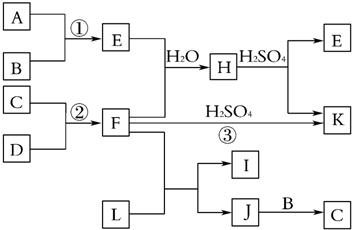
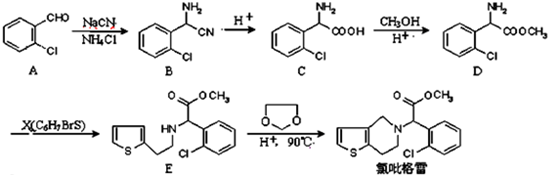
 .
. .
. ②
②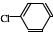 中氯原子较难水解物质A(
中氯原子较难水解物质A(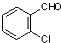 )可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式
)可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式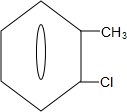 +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$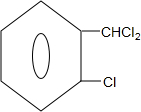 +2HCl;
+2HCl;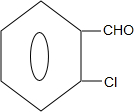 +2NaCl+2H2O
+2NaCl+2H2O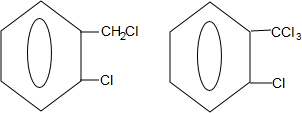
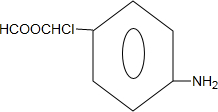
 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2$\stackrel{Br_{2}}{→}$
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2$\stackrel{Br_{2}}{→}$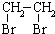
 焦亚硫酸钠(Na2S2O5)是一种常用的抗氧化剂.某研究小组对焦亚硫酸钠进行如下研究:
焦亚硫酸钠(Na2S2O5)是一种常用的抗氧化剂.某研究小组对焦亚硫酸钠进行如下研究: