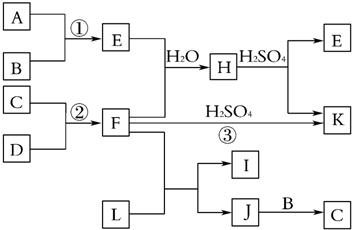
题目内容
14.下列各项中表达正确的是( )| A. | F的结构示意图 | B. | H2O的分子模型示意图 | ||
| C. | NaCl的电子式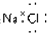 | D. | N2的结构式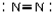 |
分析 A.该原子结构示意图中核电荷数的表示方法错误,应该为+9;
B.水分子为为V形,氧原子相对体积大于氢原子;
C.氯化钠为离子化合物,电子式中需要标出阴阳离子所带电荷;
D.氮气分子中存在氮氮三键,氮气的结构式中不能标出未成键电子对.
解答 解:A.氟原子的核电荷数=核外电子总数=9,最外层为7个电子,氟原子正确的结构示意图为: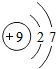 ,故A错误;
,故A错误;
B.H2O分子为V形,氧原子半径大于氢原子,则水分子的比例模型为: ,故B正确;
,故B正确;
C.氯化钠属于离子化合物,钠离子直接用离子符号表示,氯离子需要标出所带电荷及最外层电子,氯化钠正确的电子式为: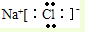 ,故C错误;
,故C错误;
D.氮气的电子式为: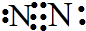 ,将所有共用电子对合成短线即为结构式,氮气正确的结构式为:N≡N,故D错误;
,将所有共用电子对合成短线即为结构式,氮气正确的结构式为:N≡N,故D错误;
故选B.
点评 本题考查了化学用语的判断,题目难度中等,试题涉及结构式、电子式、原子结构示意图、比例模型等知识,注意掌握常见化学用语的概念及表示方法,试题培养了学生的分析能力及规范答题的能力.

练习册系列答案
相关题目
4.下列说法中正确的是( )
| A. | 核外电子排布完全相同的两种微粒,其化学性质一定相同 | |
| B. | 具有固定熔点或沸点的物质一定是纯净物 | |
| C. | 一种离子和一种分子的质子数和电子数不可能同时相等 | |
| D. | 共价化合物溶于水电离过程中,共价键被破坏 |
5. 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2 型氢化物,分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q 原子s能级与p能级电子数相等;G为金属元素;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2 型氢化物,分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q 原子s能级与p能级电子数相等;G为金属元素;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
(1)Y原子核外共有7种不同运动状态的电子,T原子有7种不同能级的电子.
(2)X、Y、Z的第一电离能由小到大的顺序为C<O<N(用元素符号表示).由X、Y、Z形成的离子ZXY?与XZ2互为等电子体,则ZXY?中X原子的杂化轨道类型为sp杂化
(3)Z与R能形成化合物甲,1mol甲中含4mol化学键,甲与氢氟酸反应,生成物的分子空间构型分别为正四面体形
(4)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低,Mg2+的半径比Na+的半径小,且Mg2+电荷数高,晶格能MgF2>NaF,故MgF2的熔点比NaF高
(5)向T的硫酸盐溶液中逐滴加入Y的氢化物的水溶液至过量,反应的离子方程式为Cu2++4NH3.H2O=[Cu(NH3)4]2++4H2O
(6)X单质的晶胞如右图所示,一个X晶胞中有8个X原子;若X晶体的密度为p g/cm3,阿伏加德罗常数的值为NA,则晶体中最近的两个X原子之间的距离为$\frac{3}{4}\root{3}{\frac{12}{P{N}_{A}}}$cm(用代数式表示)
 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2 型氢化物,分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q 原子s能级与p能级电子数相等;G为金属元素;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2 型氢化物,分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q 原子s能级与p能级电子数相等;G为金属元素;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.(1)Y原子核外共有7种不同运动状态的电子,T原子有7种不同能级的电子.
(2)X、Y、Z的第一电离能由小到大的顺序为C<O<N(用元素符号表示).由X、Y、Z形成的离子ZXY?与XZ2互为等电子体,则ZXY?中X原子的杂化轨道类型为sp杂化
(3)Z与R能形成化合物甲,1mol甲中含4mol化学键,甲与氢氟酸反应,生成物的分子空间构型分别为正四面体形
(4)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低,Mg2+的半径比Na+的半径小,且Mg2+电荷数高,晶格能MgF2>NaF,故MgF2的熔点比NaF高
| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1539 | 183 |
(6)X单质的晶胞如右图所示,一个X晶胞中有8个X原子;若X晶体的密度为p g/cm3,阿伏加德罗常数的值为NA,则晶体中最近的两个X原子之间的距离为$\frac{3}{4}\root{3}{\frac{12}{P{N}_{A}}}$cm(用代数式表示)
9.下列有关NaHSO3溶液的叙述正确的是( )
| A. | 该溶液中,K+、Mg2+、Cl2、SO42-可以大量共存 | |
| B. | 已知电离平衡常数K(H2SO3)>K(H2CO3)>K(HSO3-),则该溶液中NH4+、HCO3-、Na+、Cl-不可以大量共存 | |
| C. | 和足量Ca(OH)2溶液反应的离子方程式:Ca2++OH-+HSO3-=CaSO3↓+H2O | |
| D. | 与稀HNO3反应的离子方程式:HSO3-+H+=SO2↑+H2O |
6.下列叙述中错误的是( )
| A. | 离子半径:S2->Cl->O2- | B. | 还原性:Na>Mg>Al | ||
| C. | 沸点:HF>HCl>HBr | D. | 酸性:HClO4>H2SO4>H3PO4 |
3.在电解水制H2和O2时,为了增强导电性,需加入一些电解质,下列物质可选用( )
| A. | CuSO4 | B. | HC1 | C. | NaCl | D. | NaOH |
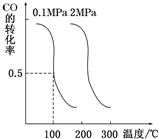 随着能源与环境问题越来越被人们关注,碳一化学成为研究的热点.“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学工艺.
随着能源与环境问题越来越被人们关注,碳一化学成为研究的热点.“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学工艺.