题目内容
13.某校研究性学习小组在实验室中模拟侯氏制碱法制取少量纯碱(见下图),并测定纯碱的纯度.回答下列问题: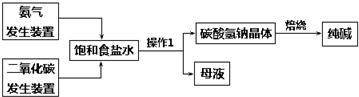
Ⅰ.纯碱的制备
(1)若上述两个气体发生装置相同,制取二氧化碳的试剂为大理石和稀盐酸,制取氨气宜选择的试剂为氯化铵固体和熟石灰固体.氨气和二氧化碳在通入饱和食盐水时的顺序是(填序号)b.
a.同时通入 b.先通氨气至饱和再通二氧化碳 c.先通二氧化碳至饱和再通氨气
(2)他们采用粗盐配制饱和食盐水.粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,除去这些杂质离子需要下列试剂:①Na2CO3溶液 ②NaOH溶液 ③BaCl2溶液 ④盐酸.加入这些试剂的顺序可以是(填序号)b.
a.①③②④b.③①④②c.②③①④d.③②①④
(3)操作1的名称叫过滤.为洗去碳酸氢钠晶体表面的残留母液,他们用酒精代替水洗,其优点是减少NaHCO3的溶解,便于晶体的干燥.
Ⅱ.纯碱纯度的测定(注:只考虑其中因焙烧不充分而含有的碳酸氢钠,忽略其他杂质)
(1)该小组同学设计了如下方案,其中不可行的是(填序号)B.
A.准确称量mg样品,加热至恒重,称量得ng固体.
B.准确称量mg样品,与足量稀硫酸反应,将产生的气体用碱石灰吸收,碱石灰增重ng.
C.准确称量mg样品,与足量氢氧化钡溶液反应,过滤、洗涤、干燥,称量得ng固体.
(2)若方案A可行,加热过程中所需仪器除了酒精灯、三角架、坩埚、坩埚钳外,还需玻璃棒、泥三角.
(3)若方案B正确,涉及反应的离子方程式为CO32-+2H+=CO2↑+H2O、HCO3-+H+=CO2↑+H2O.
(4)若方案C可行,判断沉淀是否洗净的方法是取最后一次洗涤液少许,加入少量MgCl2(aq)(或Na2SO4溶液),若不产生白色沉淀,则洗净.
分析 I.(1)制取氨气宜选择的试剂为氯化铵固体和熟石灰固体,两种气体的通入顺序为先通氨气至饱和再通二氧化碳;
(2)SO42-、Ca2+、Mg2+离子分别转化为硫酸钡、碳酸钙、氢氧化镁沉淀而除去,以及根据不能产生新杂质的要求排序,前面加入的过量溶液应用后加入的溶液除去,最后加入适量的盐酸溶液;
(3)分别不溶的固体物质,用过滤的方法;碳酸氢钠在酒精中的溶解度小,酒精易挥发,便于晶体的干燥;
Ⅱ.(1)A.准确称量mg样品,加热至恒重,称量得ng固体,通过差量求出碳酸氢钠的质量,可以求纯碱纯度;
B.准确称量mg样品,与足量稀硫酸反应,将产生的气体用碱石灰吸收,碱石灰增重ng,增重是二氧化碳和水的质量,而无法求二氧化碳的量;
C.准确称量mg样品,只有碳酸钠与氢氧化钡溶液反应,所以可以通过ng固体,求纯碱纯度;
(2)确称量mg样品,加热至恒重,称量得ng固体过程中用的酒精灯、三角架、坩埚、坩埚钳,玻璃棒和泥三角;
(3)碳酸钠与碳酸氢钠都与稀硫酸反应,反应的离子方程式分别为:CO32-+2H+=CO2↑+H2O,HCO3-+H+=CO2↑+H2O;
(4)可以取最后一次洗涤液,检验是否含有氢氧根离子和钡离子,而氢氧根离子可以用可溶的镁盐,硫酸根离子检验钡离子.
解答 解:I.(1)制取氨气宜选择的试剂为氯化铵固体和熟石灰固体,两种气体的通入顺序为先通氨气至饱和再通二氧化碳,
故答案为:氯化铵固体和熟石灰固体;b;
(2)SO42-、Ca2+、Mg2+等分别与BaCl2溶液、Na2CO3溶液、NaOH溶液反应生成沉淀,可再通过过滤除去,Na2CO3溶液能除去过量的BaCl2溶液,盐酸能除去过量的Na2CO3溶液和NaOH溶液,所以应先加③BaCl2溶液再加①Na2CO3溶液,最后加入④盐酸,氢氧化钠溶液加在过滤之前即可,所以正确顺序为③①④②,故选b;
(3)操作1的名称叫过滤;碳酸氢钠在酒精中的溶解度小,而且酒精易挥发,便于晶体的干燥;故答案为:过滤; 减少NaHCO3的溶解,便于晶体的干燥;
Ⅱ.(1)A.准确称量mg样品,加热至恒重,称量得ng固体,通过差量求出碳酸氢钠的质量,可以求纯碱纯度;
B.准确称量mg样品,与足量稀硫酸反应,将产生的气体用碱石灰吸收,碱石灰增重ng,增重是二氧化碳和水的质量,而无法求二氧化玻璃棒、泥三角碳的量,所以无法求纯碱纯度;
C.准确称量mg样品,只有碳酸钠与氢氧化钡溶液反应,所以可以通过ng固体,求纯碱纯度;
故选B;
(2)确称量mg样品,加热至恒重,称量得ng固体过程中用的酒精灯、三角架、坩埚、坩埚钳,玻璃棒和泥三角,故答案为:玻璃棒、泥三角;
(3)碳酸钠与碳酸氢钠都与稀硫酸反应,反应的离子方程式分别为:CO32-+2H+=CO2↑+H2O,HCO3-+H+=CO2↑+H2O,故答案为:CO32-+2H+=CO2↑+H2O、HCO3-+H+=CO2↑+H2O;
(4)可以取最后一次洗涤液,检验是否含有氢氧根离子和钡离子,操作为取最后一次洗涤液少许,加入少量MgCl2(aq)(或Na2SO4溶液),若不产生白色沉淀,则洗净,故答案为:取最后一次洗涤液少许,加入少量MgCl2(aq)(或Na2SO4溶液),若不产生白色沉淀,则洗净.
点评 本题以工业生产纯碱的工艺流程为背景,考查了物质的提纯、化学实验基本操作、实验结果的处理等知识,难度中等.

| A. | 丙烯分子有8个σ键,1个π键 | |
| B. | 丙烯分子中3个碳原子都是sp3杂化 | |
| C. | 丙烯分子存在非极性键 | |
| D. | 丙烯分子中3个碳原子在同一直线上 |
 汽车尾气中的主要污染物是NO和CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:(1)2NO(g)+2CO(g)?2CO2(g)+N2(g)△H=-746.5KJ/mol (条件为使用催化剂)
汽车尾气中的主要污染物是NO和CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:(1)2NO(g)+2CO(g)?2CO2(g)+N2(g)△H=-746.5KJ/mol (条件为使用催化剂)已知:2C (s)+O2(g)?2CO(g)△H=-221.0KJ/mol
C (s)+O2(g)?CO2(g)△H=-393.5KJ/mol
则N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1.
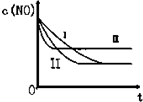
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C(NO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
A.4.20B.4.00C.3.50D.2.50
②不能作为判断该反应达到平衡状态的标志是ab.(填字母标号)
a.2v正(CO)=v正(N2)
b.容器中混合气体的密度保持不变
c.容器中气体的压强不变
d.CO2的体积分数不变
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如下图所示:
| 实验编号 | T/℃ | NO初始浓度/10-3mol•L-1 | CO初始浓度/10-3mol•L-1 | 催化剂的比表面积/m2•g-1 |
| ① | 350 | 1.20 | 5.80 | 124 |
| ② | 280 | 1.20 | 5.80 | 124 |
| ③ | 280 | 1.20 | 5.80 | 82 |
(4)已知:CO通入新制的银氨溶液中可生成银镜,同时释放一种能使湿润的红色石蕊试纸变蓝的气体.某温度下,向1L密闭容器中充入1molNO和1molCO,反应达到平衡后,将平衡混合气体通入足量新制的银氨溶液中,生成43.2g Ag,则该温度下,反应2NO(g)+2CO(g)?2CO2(g)+N2(g)(条件为使用催化剂)的化学平衡常数K=160.
(5)将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:
H2O(g)+CO(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO | H2 | |||
| ① | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| ② | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| ③ | 900 | a | b | c | d | t |
②若a=2,b=1,则c=0.6,达平衡时实验组②中H2O(g)和实验组③中CO的转化率的关系为α2 (H2O)>
α3 (CO)(填“<”、“>”或“=”).
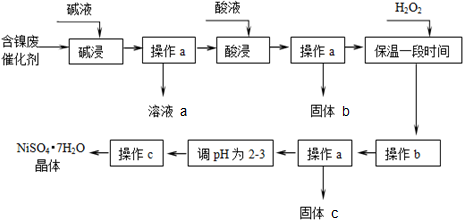
部分阳离子以氢氧化物形式沉淀时的pH如下:
| 沉淀物 | 开始沉淀 | 完全沉淀 |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
(2)“碱浸”过程中发生反应的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+H2O.
(3)“酸浸”时所加入的酸是H2SO4(填化学式).
(4)操作b为调节溶液的pH,你认为pH的最佳调控范围是3.2-7.1.
(5)溶液a中加入盐酸可制得AlCl3溶液,AlCl3溶液可用于制备聚合氯化铝,聚合氯化铝是一种新型净水剂,其中铝主要以[AlO2Al12(OH)24•(H2O)12]2+(用Alx表示)的形式存在.
①写出用溶液a与盐酸反应制备AlCl3的离子方程式:AlO2-+4H+=Al3++2H2O.
②一定条件下,向1.0mol•L-1的AlCl3溶液中加入0.6mol•L-1的NaOH溶液,可制得Aln含量约为86%的聚合氯化铝溶液.写出生成[AlO4Al12(OH)24•(H2O)12]7+的离子方程式:13Al3++32OH-+8H2O=[AlO4Al12(OH)24(H2O)12]7+.
| A. | 该反应达到平衡时,放出的热量等于92.4KJ | |
| B. | 达到平衡后向容器中通入1mol氦气,平衡不移动 | |
| C. | 降低温度和缩小容器体积均可使该反应的平衡常数增大 | |
| D. | 若达到平衡时N2的转化率为20%,则平衡时容器内的压强是起始时的80% |
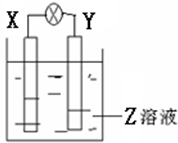 如图所示装置中,观察到电流计指针偏转,X棒变重,Y棒变轻,由此判断下表中所列X、Y、Z物质,其中可以成立的是( )
如图所示装置中,观察到电流计指针偏转,X棒变重,Y棒变轻,由此判断下表中所列X、Y、Z物质,其中可以成立的是( )| X | Y | Z | |
| A | 锌 | 铜 | 稀硫酸溶液 |
| B | 铜 | 铁 | 稀盐酸 |
| C | 锌 | 铜 | 硝酸银溶液 |
| D | 碳 | 锌 | 硝酸铜溶液 |
| A. | A | B. | B | C. | C | D. | D |
| 样品中A的质量分数/% | 20 | 50 | 70 | 90 |
| 样品的质量损失/% | 7.4 | 18.5 | 25.9 | 33.3 |
| A. | 化合物A的摩尔质量为104g•mol-1 | |
| B. | 样品A的质量分数为55%,加热至400℃样品质量损失21.35% | |
| C. | 样品A加热后的气体能使品红褪色 | |
| D. | 16.8g化合物A加热至质量不变化后,剩余固体质量为10.6g |