题目内容
11.含有的溶液中加入Fe粉(三种离子的氧化能力强弱Fe3+>Cu2+>Fe2+:):(1)若无固体剩余,溶液中一定存在的离子有Cu2+、Fe2+,可能存在的离子有Fe3+.
(2)若有铁粉剩余,则溶液中存在的离子有Fe2+.
分析 三种离子的氧化能力强弱Fe3+>Cu2+>Fe2+,
(1)若无固体剩余,Fe只能与Fe3+反应生成二价铁,不可能与Cu2+反应生成二价铁和铜单质,结合反应判断;
(2)若有铁粉剩余,Fe3+、Cu2+都与Fe反应,结合反应判断.
解答 解:三种离子的氧化能力强弱Fe3+>Cu2+>Fe2+,
(1)若无固体剩余,Fe只能与Fe3+反应生成二价铁,发生反应:2Fe3++Fe=3Fe2+,不可能与Cu2+反应生成二价铁和铜单质,所以溶液中一定存在的离子有Cu2+、Fe2+,当三价铁过量时,还可能还有Fe3+;故答案为:Cu2+、Fe2+;Fe3+;
(2)若有铁粉剩余,Fe3+、Cu2+都与Fe反应,发生反应:2Fe3++Fe=3Fe2+,Fe+Cu2+=Fe2++Cu,溶液中一定没有Cu2+、Fe3+,一定含有Fe2+,故答案为:Fe2+.
点评 本题考查了Fe3+、Cu2+的氧化能力大小的应用,根据固体的成分了解反应的先后顺序,从而确定溶液的成分,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.关于1mol•L-1的硫酸溶液的下列叙述中,不正确的是( )
| A. | 1L该溶液中含溶质98g | |
| B. | 从10mL 该溶液中取出5mL后,剩余溶液的浓度为0.5mol•L-1 | |
| C. | 将4.9g浓硫酸加入盛有50mL蒸馏水的烧杯中充分溶解就可配得该浓度的硫酸溶液 | |
| D. | 该浓度的硫酸具有酸的通性,但不具有强氧化性 |
19.下列与化学有关的说法中错误的是( )
| A. | 侯氏制碱、肥皂的制取工艺过程中均应用了物质溶解度的差异 | |
| B. | 可用蘸浓氨水的棉棒检验输送氯气的管道是否漏气 | |
| C. | 石油分馏、煤的气化、海水晒盐、碱去油污、花生中提取花生油等过程都是物理变化 | |
| D. | 利用钠的性质制造的高压钠灯,可发出射程远、透雾能力强的黄光 |
6.有一未知浓度的稀硫酸25mL,先加入25mL5mol/LBaCl2溶液后,改加NaOH溶液,结果用去1.0mol/LNaOH溶液25mL恰好完全中和.则稀硫酸的物质的量浓度为( )
| A. | 0.5mol/L | B. | 1.0mol/L | C. | 1.5mol/L | D. | 2.0mol/L |
16.短周期元素X、Y、Z、W的原子序数依次增大,X原子最外层电子数是电子层数的三倍,Y与X可形成Y2X2和Y2X两种离子化合物,Z原子的核外电子数比Y原子多1,W与X同主族,则( )
| A. | 原子半径:Y<Z<W | |
| B. | 单质的还原性:Y>Z | |
| C. | 气态氢化物的稳定性:X<W | |
| D. | Y和Z两者最高价氧化物对应的水化物能相互反应 |
1.苯与乙烯相比较,下列叙述正确的是( )
| A. | 都可以与溴发生取代反应 | |
| B. | 都容易发生加成反应 | |
| C. | 乙烯易发生加成反应,苯不能发生加成反应 | |
| D. | 乙烯易被酸性高锰酸钾溶液氧化,而苯不能 |
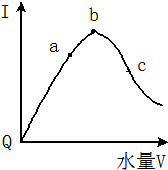 在室温下,冰醋酸加水稀释过程中,溶液导电能力I随加入水量(V表示体积)的变化曲线如图所示,请回答:
在室温下,冰醋酸加水稀释过程中,溶液导电能力I随加入水量(V表示体积)的变化曲线如图所示,请回答: