题目内容
12.实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O(1)盐酸在反应中表现出来的性质是③(填写编号).
①只有还原性 ②只有氧化性性 ③还原性和酸性 ④氧化性和酸性
(2)若反应过程中转移了0.3mol电子,则产生的Cl2在标准状况下体积3.36L.
(3)某同学欲用KMnO4固体配制50mL1.5mol•L-1的溶液.已知:KMnO4的相对分子质量为158. 回答下列问题.
①配制该KMnO4溶液时需用的主要仪器除托盘天平(带砝码)、药匙、烧杯、玻璃棒、量筒、胶头滴管外,还需50mL容量瓶(填仪器名称).
②用托盘天平称取KMnO4固体的质量应为11.9g.
分析 (1)反应生成氯气和氯化锰,以此判断盐酸的性质;
(2)反应中Cl元素化合价由-1价升高到0价,以此判断生成的氯气的体积;
(3)配制该KMnO4溶液时需要托盘天平(带砝码)、药匙、烧杯、玻璃棒、量筒、100mL容量瓶、胶头滴管;结合n=$\frac{m}{M}$=cV计算.
解答 解:(1)HCl反应生成KCl、MnCl2和Cl2,反应中盐酸表现为酸性和还原性,故答案为:③;
(2)Cl元素化合价由-1价升高到0价,由方程式可知,当生成5mol氯气时,转移10mol电子,如反应中转移了0.3mol电子,则产生0.15mol气体,体积为为0.15mol×22.4L/mol=3.36L,故答案为:3.36;
(3)①配制该KMnO4溶液时需要托盘天平(带砝码)、药匙、烧杯、玻璃棒、量筒,还需要50mL容量瓶、胶头滴管,故答案为:50mL容量瓶;
②n(KMnO4)=0.05L×1.5mol/L=0.075mol,
m(KMnO4)=0.075mol×158g/mol=11.9g,
故答案为:11.9.
点评 本题考查氧化还原反应,侧重于学生的分析能力和计算能力的考查,为高频考点,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,难度不大.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
2.下列说法中正确的是( )
| A. | NO2、SO2、BF2、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构 | |
| B. | P4和CH4都是正四面体分子且键角都为109°28ˊ | |
| C. | NaCl晶体中与每个Na+距离相等且最近的Na+共有8个 | |
| D. | 单质的晶体中一定不存在的微粒是阴离子 |
3.下列物质中,属于新型无机非金属材料的是( )
| A. | 有色玻璃 | B. | 碳化硅陶瓷 | C. | 石英玻璃 | D. | 钢化玻璃 |
20.下列离子方程式正确的是( )
| A. | 双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+2H2O | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ | |
| C. | 用铜作电极电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | |
| D. | 氯化钠与浓硫酸混合加热:H2SO4+2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+Cl2↑+H2O |
4.某研究小组为探究氯酸钾受热分解反应中的催化剂效果,在相同条件下,使用不同催化剂测量产生等量气体时所需时间,并回收催化剂,结果如下:
(1)根据实验原理,所选仪器带铁夹的铁架台、大试管(含带橡皮塞的导管)、量气装置、过滤装置、电子天平外,还必需的仪器有酒精灯、计时器(或秒表).
(2)写出实验①的化学方程式2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,根据表中信息,若实验室中无MnO2可选用上述催化剂中的Fe2O3(填化学式)代替也可基本达到同样的催化效果.
(3)实验②中的KClO3分解率为40.8%(保留一位小数).
(4)实验④中发现有刺激性气味的气体单质产生,请完成以下探究活动:
| 实验编号 | KCIO3(g) | 催化剂 | 产生气体(mL) (已折算到标准情况) | 耗时(S) | ||
| 化学式 | 质量(g) | 回收 | ||||
| ① | 0.60 | MnO2 | 0.20 | 90% | 67.2 | 36.5 |
| ② | 0.60 | CuO | 0.20 | 90% | 67.2 | 79.5 |
| ③ | 0.60 | Fe2O3 | 0.20 | 90% | 67.2 | 34.7 |
| ④ | 0.60 | Cr2O3 | 0.20 | 异常 | 67.2 | 188.3 |
(2)写出实验①的化学方程式2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,根据表中信息,若实验室中无MnO2可选用上述催化剂中的Fe2O3(填化学式)代替也可基本达到同样的催化效果.
(3)实验②中的KClO3分解率为40.8%(保留一位小数).
(4)实验④中发现有刺激性气味的气体单质产生,请完成以下探究活动:
| 提出猜想 | 该刺激性气味的气体单质可能是Cl2 |
| 设计实验 验证猜想 | 实验步骤和结论(不要求写具体操作过程)将燃着的小木条插进集气瓶中,直至木条熄灭,用玻璃棒粘着湿润的碘化钾淀粉试纸插进集气瓶中.若试纸变蓝则证明是Cl2,否则不是氯气: |
1.化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
| A. | HCl的电子式H:Cl | B. | HClO的结构式H-Cl-O | ||
| C. | Cl-的结构示意图 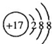 | D. | 质量数为37的氯原子${\;}_{17}^{37}Cl$ |
 (1)某学生设计的用该浓盐酸与二氧化锰反应制取并收集干燥纯净的氯气的装置如图:
(1)某学生设计的用该浓盐酸与二氧化锰反应制取并收集干燥纯净的氯气的装置如图:
 .
. .
.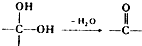 ②
②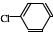 中氯原子较难水解物质A(
中氯原子较难水解物质A(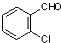 )可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式
)可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式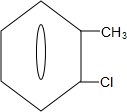 +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$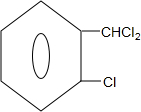 +2HCl;
+2HCl;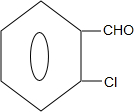 +2NaCl+2H2O
+2NaCl+2H2O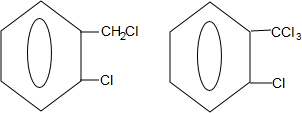
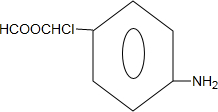
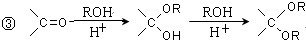
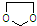 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2$\stackrel{Br_{2}}{→}$
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2$\stackrel{Br_{2}}{→}$