题目内容
19.如图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:a.A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体.b.反应①②是化工生产中的重要反应.c.化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥.d.化合物L具有漂白性,可由Cl2与NaOH溶液反应制得.e.化合物J由两种元素组成,其相对分子质量为32.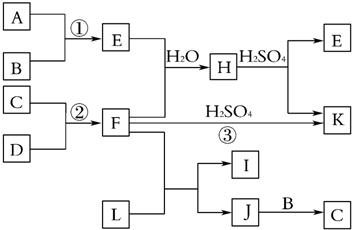
请按要求填空:
(1)A元素在元素周期表中的位置第三周期,第ⅥA族.
(2)反应③的化学方程式:2NH3+H2SO4═(NH4)2SO4.
(3)C的结构式:N≡N;F的一种用途:做致冷剂制HNO3等.
(4)L的溶液与化合物E反应的离子方程式:ClO-+SO2+2OH-═Cl-+SO42-+H2O或ClO-+SO2+H2O═Cl-+SO42-+2H+.
(5)化合物J的化学式:N2H4.
分析 由短周期元素的单质及其化合物的转化关系图可知,化合物E是形成酸雨的污染物之一,则E为SO2,A、B、C、D都是非金属单质,其中B、C、D在常温常压下是气体,则A为S,B为O2;化合物K是常用的氮肥,K为硫酸铵,所以F为氨气,则C、D分别为N2、H2;化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得,则L为NaClO,氨气与NaClO反应生成J,J由两种元素组成,它是火箭推进剂的成分之一,其相对分子质量为32,则J为N2H4;J与氧气反应生成C,C为氮气,再结合化学用语来解答.
解答 解:由短周期元素的单质及其化合物的转化关系图可知,化合物E是形成酸雨的污染物之一,则E为SO2,A、B、C、D都是非金属单质,其中B、C、D在常温常压下是气体,则A为S,B为O2;化合物K是常用的氮肥,K为硫酸铵,所以F为氨气,则C、D分别为N2、H2;化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得,则L为NaClO,氨气与NaClO反应生成J,J由两种元素组成,它是火箭推进剂的成分之一,其相对分子质量为32,则J为N2H4;J与氧气反应生成C,C为氮气,
(1)上述推断A为S,周期表中位置第三周期,第ⅥA族;
故答案为:第三周期,第ⅥA族;
(2)该反应为氨气与硫酸反应生成硫酸铵,化学反应为2NH3+H2SO4═(NH4)2SO4,
故答案为:2NH3+H2SO4═(NH4)2SO4;
(3)C为氮气,其结构式为N≡N,F为氨气,可以做致冷剂 制HNO3的原料等;
故答案为:N≡N; 做致冷剂、制HNO3等;
(4)L的溶液与化合物E反应,L为NaClO,E为SO2,在溶液中发生氧化还原反应生成氯化钠、硫酸钠,离子反应为ClO-+SO2+2OH-═Cl-+SO42-+H2O或ClO-+SO2+H2O═Cl-+SO42-+2H+,
故答案为:ClO-+SO2+2OH-═Cl-+SO42-+H2O或ClO-+SO2+H2O═Cl-+SO42-+2H+;
(4)由上述推断可知,J为N2H4,故答案为:N2H4.
点评 本题考查无机物的推断,利用物质的性质及转化关系图来推断出各物质是解答本题的关键,(3)中的离子反应为解答的易错点,注意结合氧化还原反应来解答,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| MgO | AlO3 | MgCl2 | AlCl3 | |
| 熔点/℃ | 2852 | 2072 | 714 | 190(2.5×105Pa) |
| 沸点/℃ | 3600 | 2980 | 1412 | 182.7 |
(1)工业上常用电解熔融MgCl2的方法生产金属镁,电解Al2O3与冰晶石熔融混合物的方法产生铝.为什么不用电解MgO的方法生产镁;也不用电解AlCl3的方法生产铝?答MgO的熔点太高,电解MgO消耗能量多,经济效益低;AlCl3晶体为分子,在熔融状态不电离、不导电,不能被电解.
(2)设计可靠的实验证明MgCl2、AlCl3所属的晶体类型,其实实验方法是将两种晶体加热到熔化状态,MgCl2能导电而AlCl3不能导电,故证明MgCl2为离子晶体,AlCl3为分子晶体.
| A. | F的结构示意图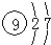 | B. | H2O的分子模型示意图 | ||
| C. | NaCl的电子式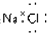 | D. | N2的结构式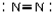 |
| 实验编号 | KCIO3(g) | 催化剂 | 产生气体(mL) (已折算到标准情况) | 耗时(S) | ||
| 化学式 | 质量(g) | 回收 | ||||
| ① | 0.60 | MnO2 | 0.20 | 90% | 67.2 | 36.5 |
| ② | 0.60 | CuO | 0.20 | 90% | 67.2 | 79.5 |
| ③ | 0.60 | Fe2O3 | 0.20 | 90% | 67.2 | 34.7 |
| ④ | 0.60 | Cr2O3 | 0.20 | 异常 | 67.2 | 188.3 |
(2)写出实验①的化学方程式2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,根据表中信息,若实验室中无MnO2可选用上述催化剂中的Fe2O3(填化学式)代替也可基本达到同样的催化效果.
(3)实验②中的KClO3分解率为40.8%(保留一位小数).
(4)实验④中发现有刺激性气味的气体单质产生,请完成以下探究活动:
| 提出猜想 | 该刺激性气味的气体单质可能是Cl2 |
| 设计实验 验证猜想 | 实验步骤和结论(不要求写具体操作过程)将燃着的小木条插进集气瓶中,直至木条熄灭,用玻璃棒粘着湿润的碘化钾淀粉试纸插进集气瓶中.若试纸变蓝则证明是Cl2,否则不是氯气: |
| A. | 溴乙烷中加入足量NaOH溶液加热,然后冷却,再加入AgNO3溶液有浅黄色沉淀生成 | |
| B. | 蔗糖溶液中加入稀H2SO4微热,再加少量新制Cu(OH)2浊液煮沸,有红色沉淀生成 | |
| C. | 将红色铜丝在酒精灯上加热后,立即插入无水乙醇中,铜丝恢复成原来的红色 | |
| D. | 用分液漏斗直接分离乙醇和苯的混合液 |


 ,②的反应类型为加成反应
,②的反应类型为加成反应
 (或
(或 )
) (1)某学生设计的用该浓盐酸与二氧化锰反应制取并收集干燥纯净的氯气的装置如图:
(1)某学生设计的用该浓盐酸与二氧化锰反应制取并收集干燥纯净的氯气的装置如图: